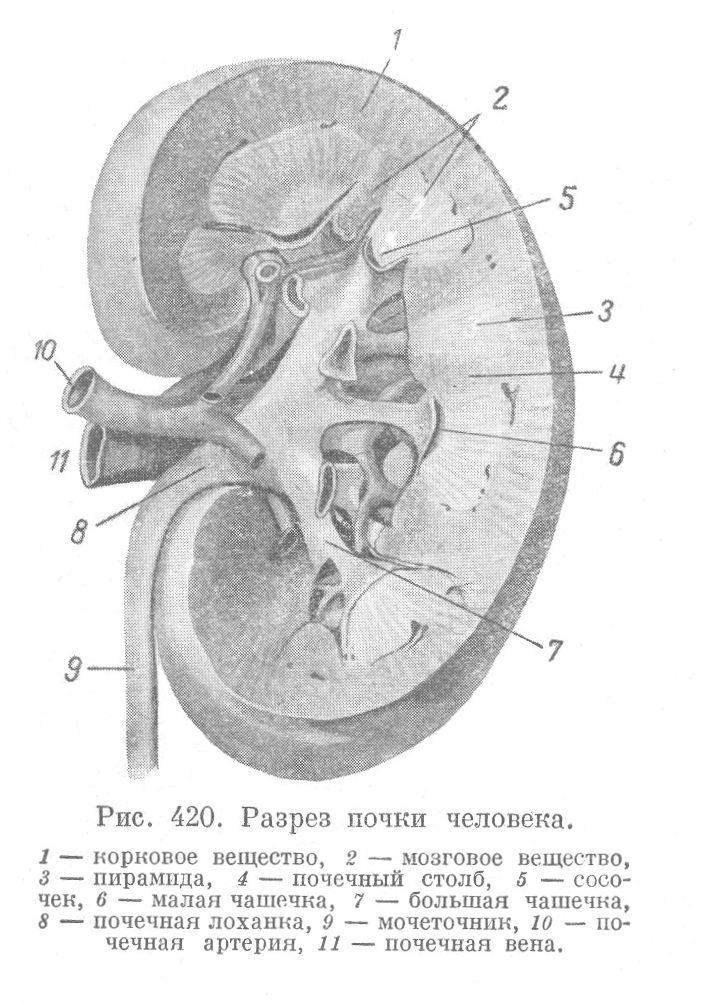
Большинство красителей, используемых в микробиологии, является солями двух типов. У кислых красителей ион, придающий окраску (хромофор), является кислотой и при окрашивании более интенсивно связывается с цитоплазматическими (основными) компонентами клетки, например эозин. У основных красителей роль хромофора играет катион. Будучи основанием, он более интенсивно связывается с ядерными (кислыми) компонентами клетки, например метиленовый синий. Некоторые красители не образуют химических соединений, а просто растворяются или осаждаются на окружающем материале. В механизме окрашивания имеют значение как химические, так и физические процессы.
Для окрашивания бактерий чаще используют основные красители: метиловый синий, кристаллический фиолетовый, основной фуксин, тионин. Широко используют щелочной раствор метиленового синего — краситель Леффлера, позволяющий выявить многие детали формы и структуры микробов.
Однако для выявления спор, капсул, жгутиков, различных структур и органелл, а также сходных по форме бактерий использование для окрашивания только одного красителя (простой способ окраски) бывает недостаточно. Поэтому существуют сложные, специальные методы окрашивания, удовлетворяющие различным требованиям.
Способ окраски по Граму позволяет дифференцировать сходные по форме и размерам бактерии, относящиеся к разным видам и родам. Мазок, приготовленный из исследуемого материала, окрашивают вначале кристаллическим фиолетовым в течение 1—2 мин, а затем раствором Люголя 1—2 мин. Все микроорганизмы, находящиеся в мазке, приобретают темно-фиолетовый цвет.
В механизме окраски по Граму имеют значение особенности химического состава микроорганизмов, различия в проницаемости клеточных стенок, наличие рибонуклеата магния у грамположительных бактерий. Между большинством грамположительных и грамотрицательных бактерий существуют различия в чувствительности к сульфаниламидам, пенициллину и лизоциму.
Способ окраски по Цилю — Нильсену предложен для кислотоустойчивых микроорганизмов — микобактерий туберкулеза и лепры. Эти микроорганизмы имеют своеобразный химический состав, отличающийся высоким (до 30—40%) содержанием особых жироподобных веществ (воски). Предварительно фиксированный на пламени мазок из мокроты больного туберкулезом окрашивают раствором карболового фуксина при дву- или троекратном подогревании до появления паров. Видимо, благодаря размягчению воска краска проникает в клетку и удерживается в ней даже при последующей обработке препарата 5% серной кислотой в течение 3—5 с; поэтому кислотоустойчивые микобактерии остаются окрашенными в красный цвет. Остальные микробы обесцвечиваются под действием кислоты и при дополнительной окраске метиленовым синим становятся синими. Для окраски спор, которые при обычных методах окраски имеют вид неокрашенных пустот, применяют протравы: кислоты и щелочи. Они разрыхляют плотную оболочку споры и облегчают проникновение через нее краски. Окрасившиеся споры обладают кислотоустойчивостью и не обесцвечиваются под действием кислоты в отличие от вегетативного тела микробной клетки. Поэтому принцип окраски спор и кислотоустойчивых бактерий одинаков. Споры можно окрасить по методу Циля—Нильсена (споры красные, вегетативное тело синее) или по Ожешко. Для этого на высушенный, но нефиксированный мазок наливают несколько капель 0,5% раствора хлористоводородной или серной кислоты и подогревают над пламенем горелки в течение 1—2 мин до закипания. Остатки кислоты сливают, препарат высушивают, фиксируют в пламени. Дальнейшую окраску производят по методу Циля — Нильсена.
Негативный метод Г и не а сочетает окраску тушью и фуксином. Мазок окрашивают по способу Бурри, затем высушивают, фиксируют спиртом и докрашивают фуксином Циля. Фон препарата черный, капсула не окрашена, бактериальная клетка красная.
Зерна волютина, находящиеся в клетках возбудителей дифтерии, выявляют, применяя окраску по Нейссеру. Этот сложный метод окраски включает несколько этапов: окраску фиксированного на пламени горелки препарата уксуснокислым синим (1—2 мин), затем добавление на мазок нескольких капель раствора Люголя на 1 мин и промывание водой. Препарат докрашивают раствором хризоидина или везувина в течение 2—3 мин, промывают водой, высушивают и микроскопируют. Зерна волютина окрашиваются в синий цвет, микробные клетки —в светло-коричневый. Методы окраски жгутиков — осаждение на них танина, который действует как протрава, т. е. способствует фиксации красителя на окрашиваемом объекте (метод Лейфсона).
Для окраски простейших, а также спирохет и риккетсий широко применяют способ Романовского — Гимзы. Используемая краска состоит из смеси азура, эозина и метиленового синего. Непосредственно перед употреблением ее растворяют дистиллированной или водопроводной водой (рН 7,0—7,2) из расчета 1 : 10. Препарат фиксируют этиловым или хметиловым спиртом в течение 5—15 мин, окрашивают 30—40 мин, высушивают и микроскопируют. Ядро простейших, жгутики и блефа- ропласт окрашиваются в ярко-красный цвет, цитоплазма— в голубой, спирохеты и риккетсии — в сиреневато - синий или розовый.
Присутствие ДНК в клетках микроорганизмов можно определить с помощью реакции Фельгена и ее модификаций. Данный метод основан на способности ядерного материала окрашиваться в темно-пурпурный цвет при обработке реактивом Шиффа, (фуксин, обесцвеченный сернистой кислотой). Предварительно фиксированный мазок обрабатывают горячим (60°С) 1 н. раствором хлористоводородной кислоты в течение 7— 8 мин для разрушения (гидролиз) РНК, наличие которой, особенно в бактериях, затрудняет выявление ДНК. Можно также разрушить РНК специальным ферментом рибонуклеазой, а для окраски использовать красители, предложенные Романовским (азур I—II и эозин).