В связи с тем что в микробиологических лабораториях работают с заразным материалом, помещение их должно быть изолировано от других больничных помещений, пищеблоков, жилых комнат. В состав лаборатории входят:
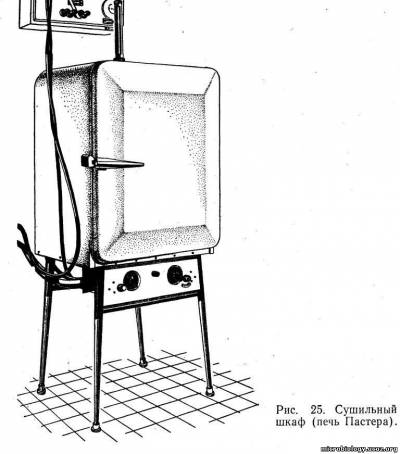
Лабораторные комнаты должны быть просторными и светлыми, желательно с ориентацией окон на север или северо-запад, так как для работы необходим рассеянный свет. Стены окрашивают светлой масляной краской, пол покрывают линолеумом, лабораторные столы — пластиком или стеклом, что позволяет их легко дезинфицировать. В лабораторной комнате оборудуют застекленный бокс с предбоксником для проведения работ в стерильных условиях.. В боксе помещают бактерицидную лампу, стол, табуретку. В лабораторных комнатах находится специальное оборудование: термостат (рис. 23), холодильник, шкафы, центрифуга и др. Большое значение имеет правильная организация рабочего места. Рабочий стол устанавливают у окна таким образом, чтобы свет падал сбоку или прямо. На столе должны находиться только необходимые для работы предметы: спиртовка или газовая горелка, штативы, бактериологические петли, банка с дезинфицирующим раствором.
Персонал во время работы должен строго соблюдать следующие правила:
Уборка помещений лаборатории. Уборку проводят ежедневно до и после работы влажным способом с применением дезинфицирующих средств. Пол протирают 2— 5% раствором карболовой кислоты или хлорамина. Стены, инвентарь и полы один раз в неделю моют горячей водой с мылом. Бокс убирают в конце рабочего дня, а утром перед работой облучают бактерицидными лампами.
Мытье лабораторной посуды. Посуду, содержащую заразный материал и культуры микробов, обеззараживают в автоклаве (рис. 24).
Техника взятия и доставки материала в микробиологическую лабораторию. Успех бактериологического исследования зависит от правильности взятия материала и своевременной доставки его в лабораторию. В зависимости от характера патологического процесса, места максимальной (избирательной) локализации возбудителя и пути его выделения в окружающую среду исследуют мокроту (при заболеваниях органов дыхания), испражнения (при желудочно-кишечных инфекциях), мочу (при поражении почек и мочевыводящих путей), гнойное отделяемое (из гнойных очагов), кровь (при кровяных инфекциях).
Испражнения собирают в стерильные картонные тарелки или судно, предварительно обработанное раствором хлорной извести и тщательно промытое горячей водой для уничтожения следов дезинфицирующего раствора. Испражнения берут стерильным шпателем и вносят в стерильную пробирку с пробкой, содержащую консервант (глицериновая смесь, фосфатно-буферная смесь и Др.). Можно брать материал специальной стеклянной ректальной трубкой, которую вводят в прямую кишку на 8— 15 см. Мочу берут стерильным катетером в стерильную пробирку или банку. Рвотные массы собирают в стерильную широкогорлую банку, которую закрывают вощаной бумагой, мокроту — в стерильную банку с пробкой или в стерильную чашку Петри. Гнойное отделяемое ран, мазки из зева и носа берут стерильным ватным тампоном на проволоке.
Кровь из вены для посева берут стерильным шприцем, предварительно обработав локтевой сгиб 75% спиртом, и у постели больного засевают в количестве 5— 10 мл во флакон с жидкой питательной средой в соотношении 1 : 10 (10 мл крови в 100 мл питательной среды).
Трупный материал для микробиологического исследования необходимо брать в первые часы после смерти, так как в дальнейшем микрофлора кишечника распространяется по всему организму. Кровь из сердца берут стерильным шприцем. Из селезенки, печени и других органов после предварительного прижигания их поверхности вырезают стерильными ножницами кусочек и помещают в стерильный сосуд. При взятии отрезка кишечника или желудка предварительно накладывают две лигатуры выше и ниже места взятия.
На каждый стеклянный сосуд с инфекционным материалом необходимо наклеить этикетку, где указывают фамилию, имя, отчество больного и дату взятия материала. Надписи делают простым карандашом. К материалу, отправляемому в лабораторию, должно прилагаться направление, в котором указываются:
Доставку инфицированного материала в лабораторию следует производить с соблюдением мер предосторожности: в закрытой посуде, в специальных металлических биксах, пеналах, чемоданах.
Доставка особо опасного материала (от больных холерой, чумой, натуральной оспой и др.) осуществляется в соответствии со специальными инструкциями. Исследуемый материал помещают в плотно закрывающиеся сосуды, обвязывают пергаментом или другим водонепроницаемым материалом, после чего их обертывают салфетками, смоченными 5% раствором фенола или лизола (необходима полная гарантия от попадания дезинфицирующего раствора в банки с материалом!). После этого сосуды помещают в жестяные коробки с крышкой или металлические биксы. При пересылке на далекие расстояния их помещают в деревянные ящики, опечатывают сургучной печатью и делают надпись: «Опасно. Не открывать во время пересылки». Доставка производится специальным транспортом в сопровождении двух лиц (один из них врач).
Поступивший в лабораторию материал регистрируют в специальном журнале. Исследуемый материал в лаборатории можно хранить: неконсервированный — при температуре 4°С не более 1—2 сут, консервированный в 50% глицерине, например кусочки органов и тканей,— в течение недель, а при необходимости длительного хранения — при замораживании до —15—20°С.
Режим работы микробиологической лаборатории зависит от степени опасности работы с тем или иным возбудителем.
Работа с культурами I и II групп инфекций проводится в специальных лабораториях только с разрешения Министерства здравоохранения, III группы — в лабораториях СЭС, IV группы — во всех бактериологических лабораториях.
В бактериологической лаборатории существуют специальные формы регистрации и учета исследуемого материала, выделенных культур, их уничтожения, передачи культур патогенных микробов внутри лаборатории и вне ее.