Методы санитарно-бактериологического исследования воды. Санитарно-бактериологические исследования воды складываются из определения степени обсемененности (микробное число) и обнаружения санитарно-показательных микроорганизмов. В отдельных случаях воду исследуют на наличие патогенных микробов.
 Точное количественное определение бактерий в воде и других объектах внешней среды (почва, пищевые продукты, лекарственные препараты и др.) представляет значительные трудности в связи с тем, что невозможно создать условия для размножения всех встречающихся в исследуемом материале микроорганизмов, так как они весьма различны по своим свойствам (аэробы и анаэробы, аутотрофы и гетеротрофы и др.). Точное количественное определение бактерий в воде и других объектах внешней среды (почва, пищевые продукты, лекарственные препараты и др.) представляет значительные трудности в связи с тем, что невозможно создать условия для размножения всех встречающихся в исследуемом материале микроорганизмов, так как они весьма различны по своим свойствам (аэробы и анаэробы, аутотрофы и гетеротрофы и др.).
Общую микробную обсемененность (микробное число) определяют в 1 мл (или 1 г) по числу колоний, вырастающих на чашке с мясопептонным агаром. Таким образом, при определений микробного числа учитываются далеко не все микроорганизмы, а лишь гетеротрофные, мезофильные и аэробные виды.
Большое значение для санитарной оценки внешней среды имеет обнаружение в ней болезнетворных микробов. Однако в связи с трудностями подобных исследований принято судить о загрязненности внешней среды по обнаружению в ней санитарно-показательных микроорганизмов. Как уже указывалось, санитарно-показательными микроорганизмами являются представители нормальной микрофлоры организма человека. Присутствие этих микробов во внешней среде говорит об ее загрязнении выделениями человека. Показателем фекального загрязнения является кишечная палочка. Для установления степени фекального загрязнения определяют титр кишечной палочки (coli-титр), т. е. наименьший объем исследуемого вещества, в котором обнаруживается кишечная палочка, и coli-индекс — количество кишечных палочек в 1 л.
Определение микробного числа воды. При определении микробного числа воды учитывают количество колоний, выросших на чашке с мясопептонным агаром при посеве определенных объемов воды. Посев производят по методу Коха. Исследуемую воду и ряд ее десятикратных разведений в объеме 1 мл вносят в стерильные чашки Петри, после чего в них наливают 12— 15 мл расплавленного и остуженного агара, быстро и тщательно перемешивают агар с водой и после застывания агара помещают чашки в перевернутом виде в термостат на 24—48 ч. Для приготовления разведений берут пробирки, содержащие по 9 мл стерильной водопроводной воды. В первую пробирку вносят 1 мл исследуемой воды (разведение 1:10). После тщательного перемешивания из первой пробирки 1 мл новой стерильной пипеткой переносят во вторую пробирку с 9 мл воды (разведение 1 : 100) и т. д. Количество разведений зависит от предполагаемой загрязненности воды (табл.).

Для определения микробного числа может быть также использован метод поверхностного посева, для чего 0,1 мл воды и ее разведений наносят стерильной пипеткой на поверхность подсушенного агара в чашке Петри и тщательно растирают по всей поверхности (до полного втирания жидкости) при помощи стерильного шпателя.
После инкубации на следующем занятии производят подсчет выросших колоний на поверхности и в глубине агара. Подсчет можно производить при помощи лупы, помещая чашку на темный фон дном кверху. При небольшой обсемененности (до 100 колоний) производят подсчет всех колоний, а если количество колоний очень велико (200, 500 и более), допускается частичный подсчет на площади не менее 1/3 чашки. В этих случаях рекомендуется пользоваться камерой (камера Вольфгюгеля) и подсчитывать колонии не менее чем в 10 квадратах, вычислить затем среднее арифметическое на один квадрат и полученное число умножить на площадь чашки (яг2). Если производится посев разведенной воды, то полученное число следует умножить на степень разведения. Результаты выражают количеством бактерий в 1 мл (микробное число).
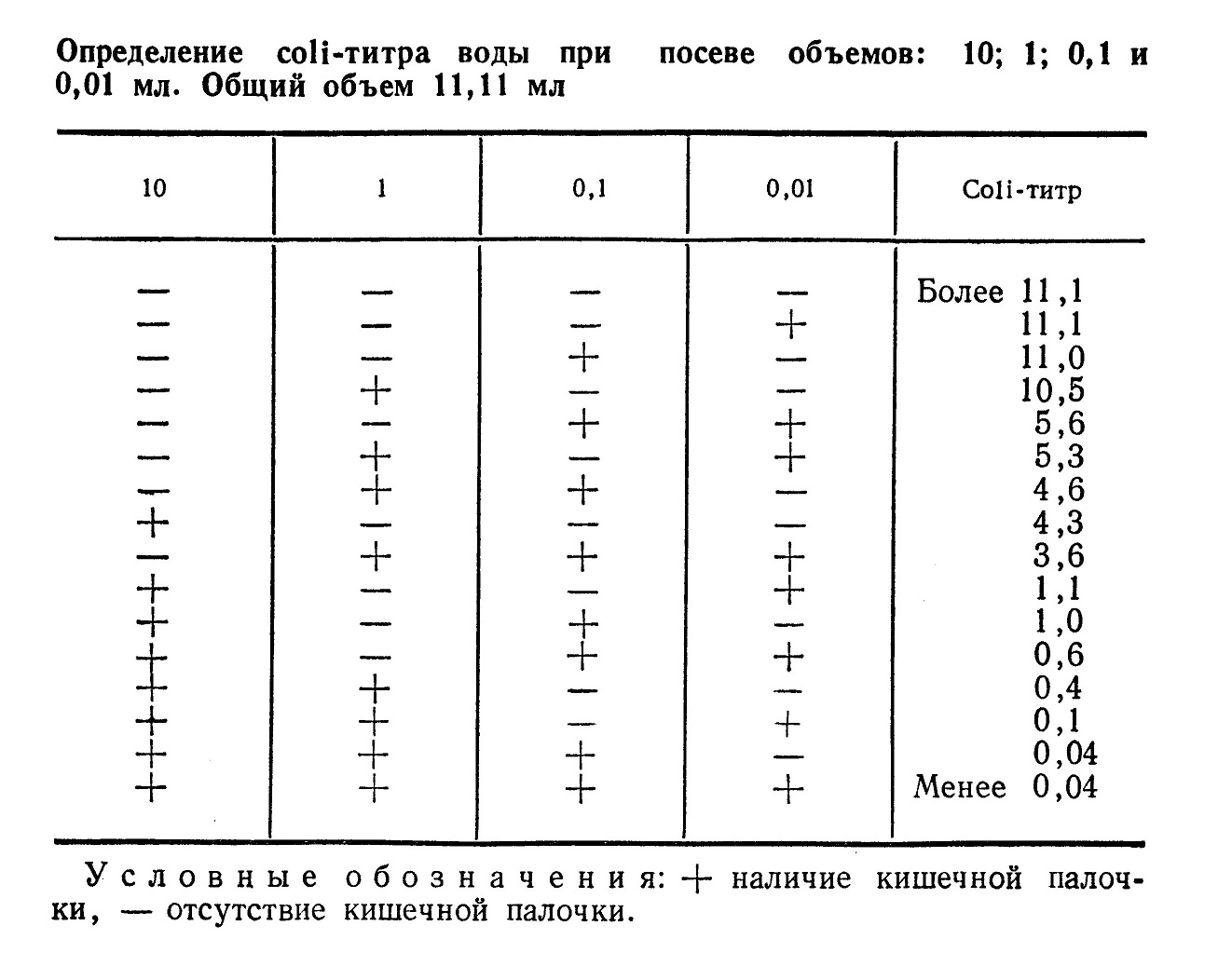
Для определения coli-титра и coli-индекса выработаны стандартные методы исследования. Определение coli-титра воды производят бродильным методом (ГОСТ 18963— 73) (табл.).

На первом этапе исследования производят посев различных объемов воды (в зависимости от предполагаемого загрязнения) на глюкозопептонную среду. Посевы помещают на сутки в термостат. Наличие кишечной палочки обнаруживается по ее способности вызывать брожение глюкозы с образованием газа.
Второй этап исследования заключается в пересеве из пробирок, в которых имеется рост (помутнение и газообразование), на дифференциально-диагностическую среду Эндо. На третий день при обнаружении на среде Эндо лактозоположительных колоний (фуксиново-красных с металлическим блеском или без него) из них приготовляют мазки и ставят оксидазный тест. Оксидазный тест заключается в следующем: на фильтровальную бумагу, смоченную соответствующим реактивом, наносят штрихом материал из 2—3 колоний со среды Эндо. Кишечная палочка не обладает оксидазной активностью и поэтому не изменяет цвета бумаги. Оксидазополскительные микробы вызывают посинение бумаги в течение одной минуты. Заканчивают определение coli-титра высевом оксидазоотрицательных колоний на полужидкую среду с глюкозой. Кишечная палочка растет на этой среде с образованием кислоты и газа.
Результат определения coli-титра устанавливают по табл.. В этой таблице следует найти результаты, соответствующие полученным при исследовании образца воды. Например, рост кишечной палочки был обнаружен при посеве 1 и 0,01 мл (шестая строка в табл.) — coli-титр равен 5,3.
На практических занятиях студенты проводят санитарно-бактериологическое исследование воды:
а) определяют микробное число воды, для чего производят посев образцов неразведенной воды и разведений в соотношении 1: 10 и 1 : 100 в расплавленный агар ;
б) для определения coli-титра засевают следующие объемы воды: 10 мл, 1 мл, 0,1 мл, 0,001 мл. Посев 10 мл воды производят на концентрированную глюкозопептонную среду и по 1 мл неразведенной воды и разведений 1:10 (0,1 мл) и 1: 100 (0,01 мл) на разведенную среду.
Coli-индекс, т. е. количество кишечных палочек в 1 л воды, определяют с помощью мембранных фильтров, которые задерживают находящиеся в воде бактерии. Через стерильную мембрану профильтровывают определенный объем воды, после чего ее помещают на поверхность среды Эндо. После пребывания чашек в течение суток в термостате при 37°С производят подсчет выросших колоний кишечной палочки на фильтре (фуксиново-красные колонии). Исследование заканчивают постановкой оксидазной пробы, для чего мембранный фильтр с ростом подозрительных колоний в перевернутом виде помещают на фильтровальную бумагу, смоченную реактивом для выявления оксидазной активности.
Методы санитарно-бактериологического исследования воздуха. Одним из методов санитарно-гигиенической оценки воздуха закрытых помещений является метод определения его бактериальной загрязненности. Обсемененность воздуха выражают количеством микробов в 1 м3 (микробное число). Для определения бактериальной загрязненности воздуха не разработано стандартных методов, в связи с чем отсутствуют и нормативы оценки обсемененности воздуха.
Самым доступным методом, не требующим специальной аппаратуры, является седиментационный метод Коха.
Для определения бактериальной обсемененности воздуха закрытых помещений чашку Петри с мясопептонным агаром открывают на 5—10 мин, после чего ее закрывают и помещают в термостат на 24 ч и затем оставляют при комнатной температуре на 24 ч. О микробной обсемененности судят по количеству выросших колоний. Этот метод не позволяет точно определять загрязненность воздуха, в связи с чем он может быть использован только для ориентировочного исследования.
Более совершенным является метод Кротова, требующий специальной аппаратуры. В аппарате Кротова воздух засасывается через щель, ударяется о поверхность питательной среды в чашке Петри. В качестве питательной среды для определения микробного числа пользуются мясопептонным агаром, а для определения санитарно показательных микроорганизмов используют специальные питательные среды; для выявления золотистого стафилококка — молочно-солевой или желточно-солевой агар и для обнаружения стрептококков — среда Гарро. Большим преимуществом этого метода является возможность посева определенного объема воздуха. Инкубирование посевов производится так же, как при посеве по методу Коха.
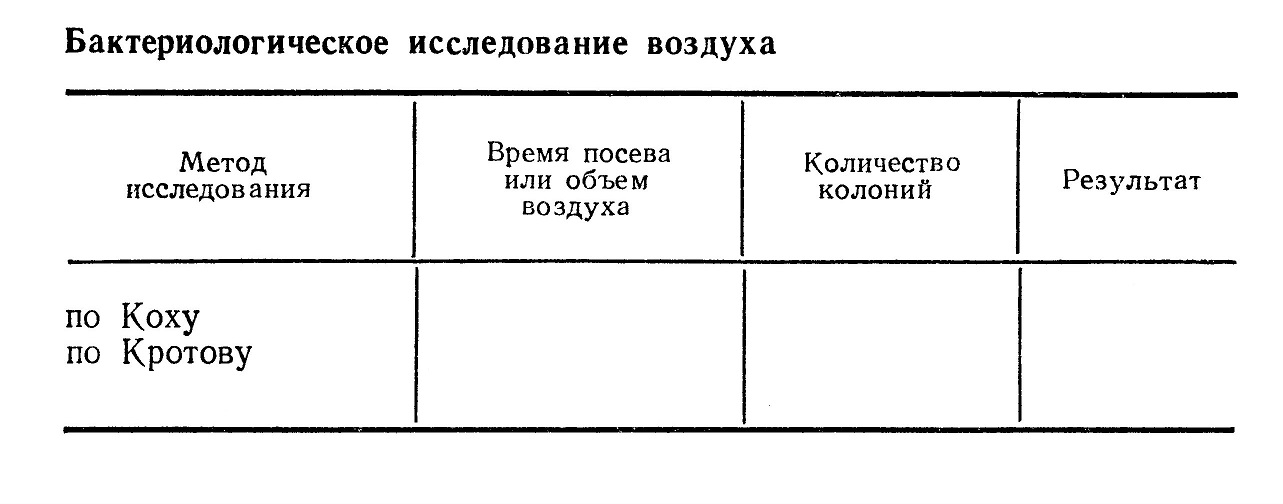
На практических занятиях студенты производят исследование воздуха по методу Коха. Открытую чашку Петри с мясопептонным агаром оставляют на столе в течение 15 мин. При исследовании воздуха по методу Кротова чашку со средой помещают на вращающийся диск аппарата и производят посев определенного обмена воздуха (100 л). Посевы помещают на сутки в термостат и на 24 ч оставляют при комнатной температуре, затем производят подсчет колоний и определение количества микробов в 1 м3 воздуха (микробное число). Результаты вносят по форме, приведенной в табл.
Бактериологическое исследование смывов с рук, посуды и других объектов. Для оценки санитарного состояния аптеки или другого учреждения (лечебное, общественного питания и пр.) производят санитарно-бактериологическое исследование различных объектов: воздух, смывы с инвентаря, рабочих столов, рук персонала, лекарственных препаратов, дистиллированной воды и др.
Эти исследования могут быть количественными, при которых определяется степень общей микробной обсемененности (микробное число), и качественными, имеющими целью определить видовой состав микрофлоры, причем особое внимание уделяется определению бактерий группы кишечных палочек как показателю фекального загрязнения. Обычно при этих исследованиях ограничиваются выделением кишечной палочки, не прибегая к определению степени фекального загрязнения. Обнаружение кишечной палочки в смывах свидетельствует о грубых нарушениях санитарного режима аптечного учреждения.
В практике санитарного надзора используют метод смывов с поверхности исследуемых объектов. В смывах определяют общую бактериальную обсемененность, причем расчет ведут на 1 см2 поверхности объекта и наличие кишечной палочки.
Санитарно-бактериологический контроль в аптеках позволяет выявить нарушения санитарного режима учреждения и проверить эффективность мероприятий, проведенных для устранения этих нарушений, а также для проверки качества мытья посуды и соблюдения правил личной гигиены работниками аптечных учреждений.
На практических занятиях студенты готовят смывы с рабочих столов, аптечной посуды, рук и пр. и подвергают их бактериологическому исследованию.
Для получения смывов с аптечной посуды в исследуемый флакон или склянку наливают 10 мл стерильного изотонического раствора хлорида натрия (физиологический раствор), тщательно встряхивая, ополаскивают всю внутреннюю поверхность сосуда.
Смывы со столов получают при помощи стерильного ватного тампона или стерильной марлевой салфетки размером 5X5 см. Тампоны помещают в пробирки с 2 мл стерильной воды (тампон не должен касаться поверхности воды). Марлевые салфетки заготовляют впрок в бумажных конвертах. Непосредственно перед взятием смывов тампоны смачивают путем погружения их в воду, а салфетки захватывают прокаленным и остуженным пинцетом и смачивают в пробирке, содержащей 2 мл стерильной водопроводной воды. После тщательного протирания исследуемого объекта смоченным тампоном (или салфеткой) его помещают в ту же пробирку. Смыв со стола производят с поверхности 100 см2, для чего используют специальные трафареты (шаблоны). Трафареты перед взятием смыва стерилизуют путем прокаливания на пламени горелки, затем накладывают на поверхность стола и с площади, ограниченной трафаретом, производят смыв тампоном (или салфеткой). После взятия смыва в пробирку добавляют 8 мл стерильной воды, в которой тщательно прополаскивают тампон.
Смывы с рук получают путем тщательного протирания ладоней, межпальцевых и подногтевых пространств влажным тампоном. Тампон помещают в пробирку, добавляют 8 мл стерильной воды, в которой тщательно прополаскивают тампон.
Из исходных смывов в зависимости от предполагаемой степени бактериальной загрязненности приготовляют ряд десятикратных разведений.
Смывы исследуют на общее бактериальное загрязнение (микробное число) по методике, описанной при определении микробного числа воды, и на наличие бактерий группы кишечных палочек и золотистого стафилококка.
Для определения бактерий группы кишечных палочек в пробирку с тампоном после взятия смыва наливают 5 мл среды Кесслера и помещают пробирки в термостат при температуре 43°С на 24 ч. При наличии роста производят высев на дифференциально-диагностическую среду Эндо. Рост на этой среде типичных красных колоний укажет на наличие в смывах кишечной палочки. Заканчивается исследование постановкой оксидазной пробы.
Состав среды Кесслера: к 1 л воды прибавляют Юг пептона, 50 мл бычьей желчи, 10 г лактозы и 4 мл 1% водного раствора генциана фиолетового.
Для обнаружения золотистого стафилококка смыв в количестве 3—4 капель засевают на чашки Петри с желточно-солевым агаром. После инкубирования в течение 24 ч при 37°С изучают свойства выделенных культур стафилококка (табл.).
 Занятие 1-е. Вакцины и анатоксины. Вопросы для обсуждения. 1. Искусственный иммунитет, активный и пассивный. 2. Препараты для создания искусственного активного иммунитета: вакцины и анатоксины. 3. Виды вакцин: живые, убитые и химические. 4. Способы приготовления вакцин. 5. Анатоксины нативные и очищенные, их получение и титрован... Читать далее... |
|  Точное количественное определение бактерий в воде и других объектах внешней среды (почва, пищевые продукты, лекарственные препараты и др.) представляет значительные трудности в связи с тем, что невозможно создать условия для размножения всех встречающихся в исследуемом материале микроорганизмов, так как они весьма различны по своим свойствам (аэробы и анаэробы, аутотрофы и гетеротрофы и др.).
Точное количественное определение бактерий в воде и других объектах внешней среды (почва, пищевые продукты, лекарственные препараты и др.) представляет значительные трудности в связи с тем, что невозможно создать условия для размножения всех встречающихся в исследуемом материале микроорганизмов, так как они весьма различны по своим свойствам (аэробы и анаэробы, аутотрофы и гетеротрофы и др.).