Действие физических факторов на бактерии. Жизнь бактерий находится в тесной зависимости от условий внешней среды. Одни из факторов внешней среды оказывают на микробы благоприятное, другие — губительное действие. Изучение законов взаимоотношений между миром микробов и окружающей средой имеет большое практическое значение.
Действие температуры. Среди физических факторов особое значение в жизни микробов имеет температура. Жизнедеятельность микробов проявляется только при определенных температурных условиях. Различают три кардинальные температурные точки: минимум, оптимум и максимум. Между нижним и верхним пределами возможна жизнедеятельность микробов, а оптимум соответствует физиологической норме для данного вида. Для патогенных микробов, приспособившихся к жизни в организме человека, оптимум соответствует температуре 37°С. Колебания между максимальной и минимальной температурными точками для многих бактерий достигают 40° (5°—45°С).
Температурные границы роста для разных бактерий различны. Холодолюбивые микробы (психрофилы) размножаются при низких температурах, термофилы (теплолюбивые) могут размножаться при очень высоких температурах, достигающих 70—75°С. Промежуточную, наиболее обширную, группу составляют мезофилы, растущие при средних температурах. Патогенные бактерии и большинство микробов-сапрофитов являются мезофилами.
Культивирование бактерий в лабораториях производится в аппаратах с постоянной температурой — термостатах, которые для культивирования патогенных бактерий установлены на температуру 37°С.
 Термостат представляет собой шкаф большей или меньшей величины с двойными стенками, сделанными из дерева, асбеста или металла. Подогрев термостата обычно производится электричеством. Основной частью термостата является терморегулятор, который обеспечивает постоянную температуру термостата. Имеется много систем терморегуляторов, но все они построены на одном принципе — расширении тел при нагревании. При нагревании термостата выше установленной температуры происходит размыкание в электроцепи. Термостат представляет собой шкаф большей или меньшей величины с двойными стенками, сделанными из дерева, асбеста или металла. Подогрев термостата обычно производится электричеством. Основной частью термостата является терморегулятор, который обеспечивает постоянную температуру термостата. Имеется много систем терморегуляторов, но все они построены на одном принципе — расширении тел при нагревании. При нагревании термостата выше установленной температуры происходит размыкание в электроцепи.
Высокие температуры оказывают на микробы губительное действие, так как они вызывают коагуляцию белка цитоплазмы микробной клетки. Большинство вегетативных форм бактерий погибает уже при 10-минутном воздействии температуры 70°С и моментально при температуре 100°С. Большой устойчивостью к высоким температурам обладают бактериальные споры. Они могут сохранять способность к прорастанию даже после многочасового кипячения и только при температуре пара 120°С и сухого жара 165—170°С они погибают.
На действии высоких температур основан целый ряд методов стерилизации, т. е. полного уничтожения микробов.
При температуре ниже минимальной жизнедеятельность микробов прекращается, однако при низких температурах, даже в пределах —193°С (температура жидкого воздуха) и —252°С (температура жидкого водорода), большинство бактерий не погибает. В связи с тем что при низких температурах полностью прекращается жизнедеятельность микробов, низкие температуры широко используются в пищевой промышленности и быту для сохранения пищевых продуктов, а в аптеках при хранении лекарств.
Методы стерилизации. Выбор метода стерилизации связан со свойствами материала, подлежащего стерилизации. В практике нашли наибольшее применение следующие методы: прокаливание, стерилизация сухим жаром, текучим паром и паром под давлением.
Стерилизация прокаливанием на пламени горелки имеет ограниченное применение, так как большинство предметов от прокаливания портятся. Прокаливанием стерилизуют бактериальные петли, пинцеты, предметные стекла.
Сухим жаром стерилизуют лабораторную и аптечную посуду. Стерилизация сухим жаром производится в специальных аппаратах (печь Пастера, сушильный шкаф), в которых в течение 45 мин поддерживается температура 165— 170°С.
Для стерилизации питательных сред, перевязочного материала и других предметов, портящихся от сухого жара, используется стерилизация паром под давлением или автоклавирование. Автоклавирование проводится в герметически закрывающихся котлах — автоклавах. При давлении в 2 атм температура пара достигает 120°С. При этой температуре споры бактерий погибают в течение 15—20 мин. Длительность автоклавирования зависит от объема и характера стерилизуемого материала.
Объекты, не выносящие температуры 120°С (питательные среды, содержащие углеводы, желатин и др.), можно стерилизовать дробным методом текучим паром (100°С). Стерилизация текучим паром производится в аппарате Коха или в автоклаве с незавинченными краном и крышкой. Стерилизуют этим методом 3 дня подряд по 30—40 мин. Между прогреваниями стерилизуемый материал оставляют при комнатной температуре. Стерилизовать этим методом можно только питательные среды, так как в стерилизуемом материале должны быть обеспечены условия, необходимые для прорастания спор. При нагревании до 100°С погибают только вегетативные формы бактерий, споры же остаются жизнеспособными и при наличии питательного субстрата и подходящей температуры прорастают в вегетативные формы, которые погибают при следующем прогревании.
Если объекты, подлежащие стерилизации, не выдерживают температуры 100°С, то в этих случаях можно воспользоваться методом дробной стерилизации при температуре 56—60°С — тиндализацией. Тиндализация проводится 5—6 дней подряд по часу на водяной бане или в специальном аппарате с терморегулятором; первый день прогревают в течение 2 ч.
Аппараты для стерилизации, их устройство и работа. Автоклав представляет собой цилиндрический толстостенный металлический котел с герметически закрывающейся крышкой, завинчивающейся винтами. Автоклав снабжен манометром, краном для выпускания пара, предохранительным клапаном и водомерным стеклом.
Перед стерилизацией в автоклав наливают воду, уровень которой контролируют по водомерному стеклу. Поместив в автоклав материалы, подлежащие стерилизации, плотно завинчивают крышку, оставляя открытым кран. Для подогрева автоклава можно пользоваться электроэнергией, газом или керосином. Когда вода в автоклаве закипит, то из крана начнет выходить пар вместе с воздухом, находившимся в автоклаве. Необходимо, чтобы весь воздух был вытеснен из автоклава, так как в противном случае показания манометра не будут соответствовать температуре в автоклаве.
Появление непрерывной сильной струи пара указывает на полное удаление воздуха из автоклава, после чего следует закрыть кран. Регулируя нагрев, поддерживают давление на заданном уровне в течение всего времени стерилизации. По окончании стерилизации выключают подогрев и дают давлению самопроизвольно снизиться и только после этого открывают кран и выпускают пар из автоклава. Если открыть крышку автоклава раньше, чем стрелка манометра опустится до нуля, то стерилизуемые жидкости, нагретые выше 100°С, закипят и могут смочить и даже вытолкнуть ватные пробки.
При давлении пара в 1,5 атм (по показанию манометра 0,5 атм) температура пара равна 112°С, при 2 атм 120°С, при 3 атм 134°С.
Аппарат Коха для дробной стерилизации текучим паром представляет собой одностенный металлический цилиндр, покрытый снаружи линолеумом или асбестом. Аппарат закрывают крышкой, в которой имеются отверстия для выхода пара и для термометра. Перед стерилизацией в аппарат наливают воду, об уровне которой судят по показанию водомерной трубки. На подставки помешают сетки с питательными средами, подлежащими стерилизации. Подогрев производят снизу. При кипении воды пар непрерывной струей выходит через отверстие в крышке, при этом температура в аппарате достигает 100°С.
Для стерилизации сухим жаром служит сушильный шкаф с терморегулятором или печь Пастера. Сушильный шкаф представляет собой двухстенный металлический шкаф. В верхней стенке шкафа имеется вытяжная труба и отверстие для термометра. Постоянная температура при стерилизации сухим жаром поддерживается при помощи терморегулятора. Нагрев прибора осуществляется снизу, что обеспечивает циркуляцию нагретого воздуха.
По окончании стерилизации шкаф открывают только после того, как он достаточно остыл, иначе стеклянная посуда может потрескаться.
На практических занятиях изучение действия температурного фактора на микроорганизмы проводится в опыте стерилизации материала, содержащего образующие и не образующие споры бактерии. В пробирках с изотоническим стерильным раствором хлорида натрия приготовляют взвеси из культур бактерий, образующих споры (сенная палочка, антракоид), и бактерий, не образующих споры (кишечная палочка, стафилококк). Пробирку со взвесью спорообразующего микроба помещают в автоклав на 15 мин, а две пробирки со взвесями образующих и не образующих спор бактерий помещают в кипящую водяную баню на 10 мин. Для учета результатов из каждой пробирки производят высев на косой агар. Регистрация результатов по прилагаемой форме (табл.) производится на следующем занятии после пребывания посевов в термостате.

Действие лучистой энергии. Свет обладает губительным действием на микробы. Прямой солнечный свет убивает микробы в сроки от нескольких минут до нескольких часов. Наибольшей бактерицидной активностью обладают фиолетовая и ультрафиолетовая части спектра. Бактерицидное действие ультрафиолетовых лучей находит широкое использование для обеспложивания воздуха таких помещений, как операционные, больничные палаты, лаборатории, аптеки и др., а также некоторых промышленных помещений (холодильники и др.) .
Для обеззараживания воздуха пользуются бактерицидными лампами.
Ввиду неблагоприятного действия ультрафиолетовых лучей на организм человека бактерицидные лампы следует включать только при отсутствии людей в помещении.
Бактерицидное действие ультрафиолетовых лучей можно продемонстрировать на следующем опыте. На чашку с мясопептонным агаром при помощи пастеровской пипетки наносят каплю бульонной культуры кишечной палочки, которую затем тщательно растирают стерильным шпателем по всей поверхности агара. После этого снимают крышку и половину чашки прикрывают куском картона, а затем чашку с посевом подвергают облучению бактерицидной лампой в течение 10 мин. После облучения чашку закрывают и помещают в термостат. Результаты опыта регистрируют через сутки. На половине чашки, защищенной от действия ультрафиолетовых лучей, обнаруживается обильный рост засеянной культуры, тогда как на другой половине, подвергавшейся действию ультрафиолетовых лучей, рост отсутствует.
Губительное действие физических факторов (температура, лучистая энергия) на микробы используют для создания условий асептики. Под асептикой понимают полное уничтожение микробов во внешней среде, осуществляемое применением физических факторов. Условия асептики необходимы в хирургической практике, работе микробиологических лабораторий, при изготовлении стерильных лекарственных форм и проч.
Бактериальные фильтры. Стерилизация жидкостей, портящихся от нагревания, может производиться путем фильтрования через бактериальные фильтры (механическая стерилизация). Фильтрование может производиться через различные пористые материалы: керамические фильтры (фильтровальные свечи), асбестовые фильтры (фильтры Зейтца), коллодийные и стеклянные фильтры. Наибольшее применение получили фильтры Зейтца. Перед употреблением пластину асбестового фильтра закрепляют в специальном металлическом приборе. Трубку нижней части прибора вставляют через резиновую пробку в специальную колбу с отводной трубкой. Колбу, в которую должна фильтроваться жидкость, присоединяют к масляному насосу для создания вакуума. Перед употреблением собранный фильтр Зейтца стерилизуют в автоклаве.
Стерилизацией фильтрованием пользуются в практике приготовления ряда стерильных лечебных препаратов (лечебные сыворотки, бактериофаги, антибиотики и пр.).
На практических занятиях студенты знакомятся с устройством и работой бактериальных фильтров. Бульонную культуру кишечной палочки или какого-либо другого микроба фильтруют через бактериальный фильтр Зейтца. Фильтрат проверяют на стерильность посевом на пробирки с мясопептонным бульоном и косым агаром. Результаты проверки стерильности регистрируют на следующем занятии после пребывания посевов в термостате.
Действие на микробы химических факторов. Дезинфекция — уничтожение в окружающей среде возбудителей инфекционных заболеваний при помощи химических веществ — направлена на перерыв путей передачи инфекции. Для дезинфекции используется ряд химических веществ, обладающих сильно выраженным антимикробным действием. Большинство дезинфицирующих (антисептических) веществ относится к группе общепротоплазматических ядов, т. е. ядов, действующих не только на микробы, но и на любые животные и растительные клетки.
К действию химических факторов, так же как и к действию всех других факторов внешней среды, споры бактерий обладают большей устойчивостью, чем вегетативные формы.
Для целей дезинфекции употребляют следующие вещества: 0,1—0,2% растворы сулемы и другие соединения ртути, 3—5% растворы фенола, хлорную известь в виде 10—20% раствора, 0,2—0,5% раствора хлорамина, 1— 4% раствор формалина. Дезинфицирующими свойствами обладают 70° этиловый спирт, щелочи и кислоты различной концентрации.
Антисептика, т. е. обеззараживание с помощью химических веществ, обладающих антимикробным действием, совместно с асептикой широко используются в хирургической практике.
В микробиологической лаборатории дезинфицирующими веществами пользуются для обеспложивания использованной посуды (пипетки, предметные стекла и проч.), рабочего места, рук и др.
Выбор дезинфицирующего вещества и длительность его воздействия диктуется как особенностями микроорганизма, так и средой, в которой будет происходить контакт дезинфицирующего вещества с патогенным микробом.
Для испытания действия дезинфицирующих веществ обычно пользуются культурами следующих микробов: стафилококк, кишечная палочка и антракоид, последний является спорообразующим микробом. Взвесью культур этих микробов пропитывают кусочки стерильной хлопчатобумажной ткани (бактериальные тесты), которые затем служат для определения действия дезинфицирующих веществ на бактерии, обладающие различной степенью устойчивости.
Под дезинсекцией понимают уничтожение членистоногих (вши, клещи), которые являются переносчиками ряда инфекционных заболеваний. В борьбе с этими инфекциями (трансмиссивные инфекции) дезинсекции принадлежит решающая роль.
Дератизация — истребление грызунов, опасных в эпидемиологическом отношении (при чуме, туляремии).
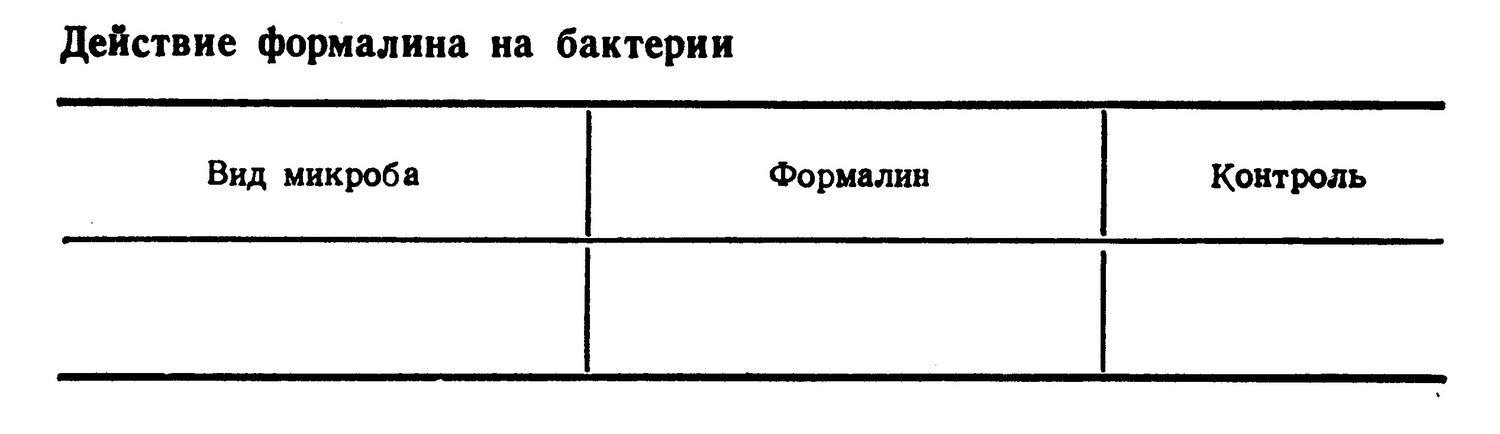
На практических занятиях для изучения действия химических факторов на микроорганизмы студенты ставят следующий опыт: определение действия паров формалина на образующие и не образующие споры бактерии.
Испытание дезинфицирующего действия формалина. На две пробирки скошенного агара производят посев антракоида и кишечной палочки, после чего под ватную пробку вкладывают полоски фильтровальной бумаги, смоченной формалином. Контролем служат пробирки с посевами, не подвергавшиеся действию формалина. Посевы помещают в термостат. Результаты учитывают на следующем занятии и вносят в табл.
Химиотерапевтические вещества. Химиотерапией называют лечение инфекционных заболеваний химическими веществами, обладающими избирательным действием на микроб-возбудитель и не оказывающими вреда организму больного. В отличие от дезинфицирующих веществ химиотерапевтические препараты обладают выраженной специфичностью, то есть действуют на определенные виды микробов. Химиотерапевтические вещества могут оказывать на микробы бактерицидное (убивающее) или бактериостатическое (задерживающее размножение) действие. Механизм действия различных химиотерапевтических препаратов может быть различным: нарушение обмена веществ микробной клетки, инактивация ферментов, нарушение клеточных мембран, процессов деления клетки и др.
Химиотерапевтическими препаратами широко пользуются для лечения инфекционных заболеваний. Так, при сифилисе, возвратном тифе с большим успехом применяют препараты мышьяка (новарсенол, осарсол и др.), при малярии — акрихин, бигумаль. Для лечения ряда бактериальных инфекций (стафилострептококковые, дизентерия и др.) наряду с антибиотиками применяют сульфаниламидные и другие химиотерапевтические препараты.
На практических занятиях студенты знакомятся с демонстрацией различных химиотерапевтических препаратов.
 Занятие 1-е. Вакцины и анатоксины. Вопросы для обсуждения. 1. Искусственный иммунитет, активный и пассивный. 2. Препараты для создания искусственного активного иммунитета: вакцины и анатоксины. 3. Виды вакцин: живые, убитые и химические. 4. Способы приготовления вакцин. 5. Анатоксины нативные и очищенные, их получение и титрован... Читать далее... |
|  Термостат представляет собой шкаф большей или меньшей величины с двойными стенками, сделанными из дерева, асбеста или металла. Подогрев термостата обычно производится электричеством. Основной частью термостата является терморегулятор, который обеспечивает постоянную температуру термостата. Имеется много систем терморегуляторов, но все они построены на одном принципе — расширении тел при нагревании. При нагревании термостата выше установленной температуры происходит размыкание в электроцепи.
Термостат представляет собой шкаф большей или меньшей величины с двойными стенками, сделанными из дерева, асбеста или металла. Подогрев термостата обычно производится электричеством. Основной частью термостата является терморегулятор, который обеспечивает постоянную температуру термостата. Имеется много систем терморегуляторов, но все они построены на одном принципе — расширении тел при нагревании. При нагревании термостата выше установленной температуры происходит размыкание в электроцепи.