Инфаркт миокарда представляет собой наиболее типичное проявление коронарной недостаточности, а атеросклероз — наиболее частый фон ее возникновения. Следовательно, понятие коронарной недостаточности шире представления об инфаркте миокарда и об атеросклерозе артерий сердца. И, действительно, коронарная недостаточность с разнообразными клиническими и анатомическими симптомами (грудная жаба, сердечная астма, инфаркт миокарда, кардиосклероз, внезапный паралич сердца и т. п.) может иметь и другую основу, помимо атеросклероза, а именно сифилис венечных артерий, узловатый периартериит, эмболию и т. и.
Так или иначе «коронарный атеросклероз и грудная жаба в сущности различные понятия» (Г. Ф. Ланг).
Частота стенозирующего атеросклероза при смерти от острой коронарной недостаточности и инфаркта миокарда в различные возрастные периоды неодинакова. Так, по данным А. В. Смольянникова, у лиц до 40 лет стенозирующий атеросклероз отсутствовал в 20% случаев, в возрасте 41—50 лет — в 7,2%, от 51 года до 60 лет — в 4,3%, у лиц старше 61 года — в 2,4% случаев.
Эти данные свидетельствуют о том, что стенозирующий атеросклероз венечных артерий сердца не является обязательной предпосылкой для развития коронарной недостаточности и инфаркта миокарда.
Не вполне совпадающими будут также понятия «инфаркт миокарда» и «грудная жаба»: если первый практически не бывает без второй, то грудная жаба может быть и без инфаркта.
Инфаркты миокарда наблюдаются, как правило, в левом желудочке, ближе к верхушке, на передней и задней стенке, реже в области перегородки. Нередко инфаркт касается папиллярных мышц, особенно заднего паруса. Величина инфарктов колеблется от 1—2 см до размеров ладони; некоторые из них обнаруживаются лишь при микроскопическом исследовании. Чаще всего некротизируются внутренние, т. е. субэндокардиальные, пласты миокарда (рис. 18а), реже—наружные. Это связано с меньшей обеспеченностью внутренних слоев в отношении кровоснабжения, а возможно, и с механическим давлением крови на эти слои миокарда. Характерные для инфарктов миокарда электрокардиограммы отражают в основном факт поражения внутренних пластов миокарда.
Иногда наступает сквозной некроз, что приводит к развитию серозно-фиброзного или геморрагического перикардита (pericarditis epistenocardica), а также может вести к разрыву сердца.
Разрыв сердца в большей части случаев наступает в течение первых 4 дней развития инфаркта (С. Г. Моисеев, 1954). Спустя 14 дней разрывы уже не наблюдаются (О. И. Глазова, 1956). Изредка разрывы бывают при скрыто протекавших инфарктах.
Местом разрыва бывает как передняя, так и задняя стенка левого желудочка. Разрыв (см. рис. 18) обычно не носит характера зияющего отверстия, а имеет вид неровной щели, края которой пропитаны кровью. Много крови находят в полости перикарда, — так называемая тампонада сердца. Щель, соединяющая полость сердца с полостью перикарда, по своему профилю очень извилиста; это говорит о том, что разрыв не бывает моментальным, что он слагается из ряда следующих один за другим надрывов, из которых последний (эпикардиальный) и является решающим.
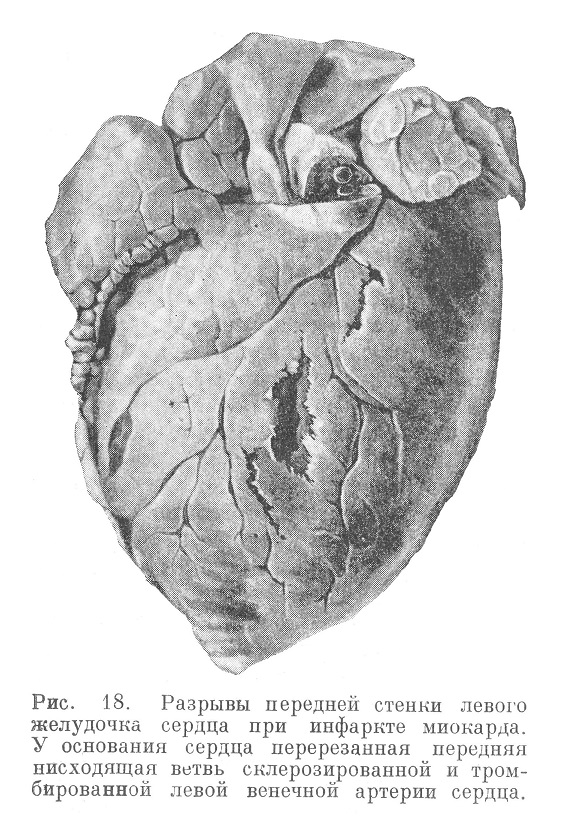
Изредка наблюдается внутренний разрыв сердца (рис. 19), а именно межжелудочковой перегородки с последующим сообщением обоих желудочков. К внутренним разрывам следует отнести и отрыв папиллярных мышц при некрозах в них.
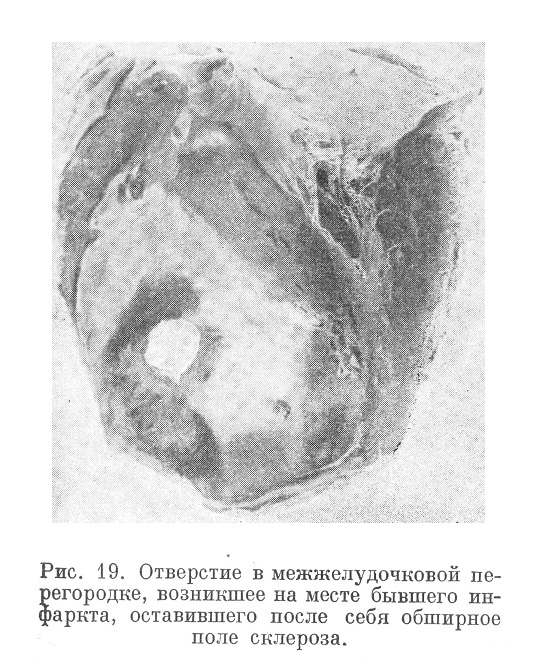
Обычно разрыв сердца влечет за собой скоропостижную смерть. Но это бывает не всегда. Разрыв может быть небольшой, к тому же некоторую кровоостанавливающую роль играют и те тромботические явления, которые одновременно развиваются со стороны полости желудочка на почве субэндокардиальных некрозов миокарда (см. рис. 18а).
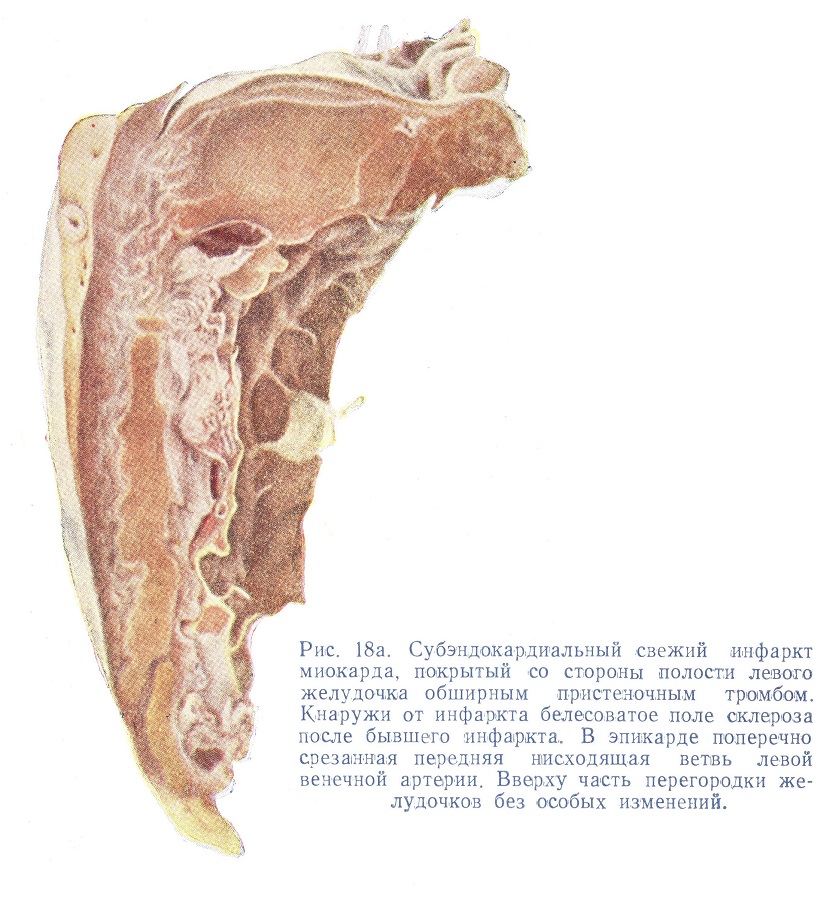
Возникающие здесь тромбы нередко служат источником эмболий, например сосудов мозга, почек, конечностей. Место инфаркта, особенно если он крупных размеров, значительно выбухает, возникает острая аневризма сердца. Может развиваться и общее расширение сердца с относительной недостаточностью клапанов, например двустворчатого.
Макроскопически инфаркты миокарда выглядят или как резко анемические желтовато-коричневые участки (ишемические инфаркты), или как темно-красные фокусы (геморрагические инфаркты); нередко те и другие чередуются. Геморрагическая зона вокруг ишемического инфаркта связана, по-видимому, с массирующим действием на инфаркт сокращающегося сердца. Освобождающиеся при некрозе миокарда метаболиты, оказывая сосудорасширяющее действие, также способствуют развитию кровоизлияний. Обычно место свежего инфаркта на ощупь является несколько размягченным (миомаляция).
При гистологическом исследовании (рис. 20) обнаруживают исчезновение окраски ядер мышечных волокон, потерю ими поперечной полосатости (далеко не всегда!), глыбчатый распад протоплазмы, разрыв волокон в продольном и поперечном направлении, гиперемию, кровоизлияния или, наоборот (при ишемическом инфаркте), полное запустение и спадение сосудов.
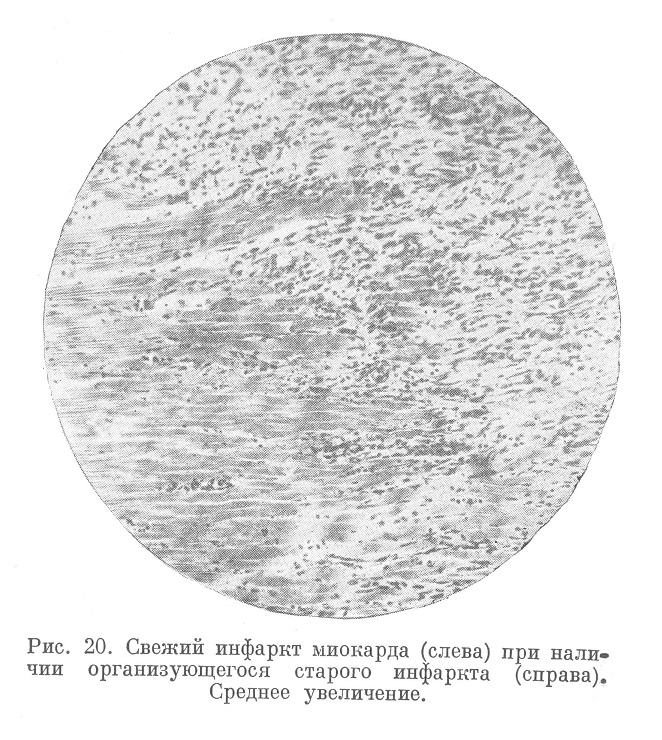
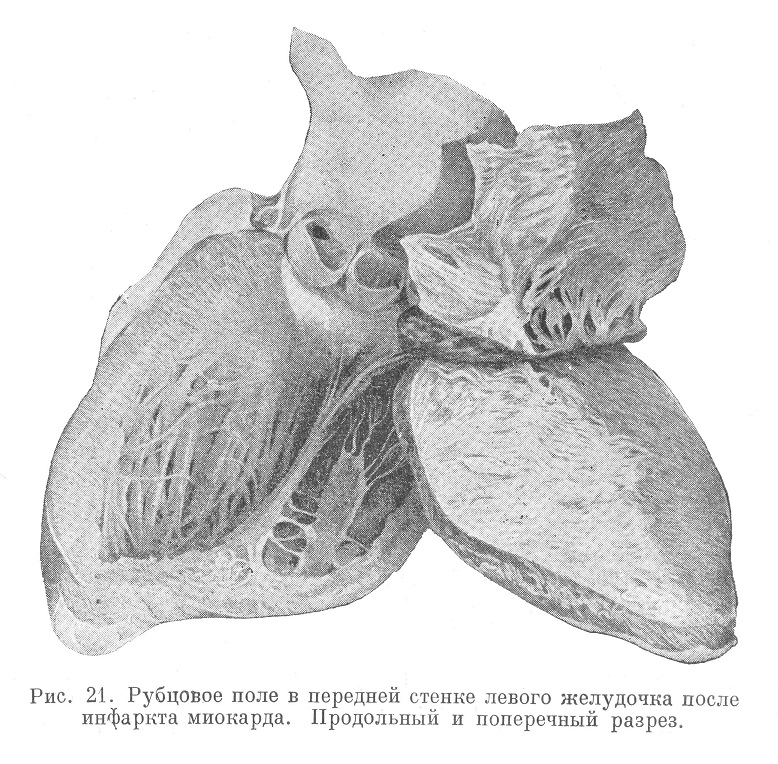
Позднее участки некротизированного субстрата теряют цвет мускулатуры, становятся зеленовато-серыми, суховатыми, а при микроскопировании отмечают полный распад волокон и по периферии ту или иную степень реакции в виде массовой эмиграции лейкоцитов. В дальнейшем по общим законам организации инфарктов наступает рассасывание мышечного детрита; кроме того, идет развитие грануляционной ткани (см. рис. 20), приводящее к замещению инфаркта белесоватым рубцовым полем (рис. 21, см. также рис. 18а). Регенерация мышечных волокон ничтожна и практического значения не имеет.
Значительные трудности возникают при определении самых ранних случаев, когда от момента приступа стенокардии до наступления смерти прошло лишь несколько десятков минут и развития типичного инфаркта еще не последовало. Можно считать, что в пределах первых часов после приступа возможны лишь косвенные доказательства этого события, т. е. находят тромбоз артерии (далеко не всегда), неравномерное кровенаполнение, небольшую дряблость миокарда, расширение полости сердца. Иногда в таких ранних случаях обнаруживают зернисто-глыбчатый распад отдельных волокон, диссоциацию их (отек миокарда), эозинофилию волокон и т. п. Типично сформированный инфаркт обнаруживается через 2—3 дня.
Гистохимический анализ обнаруживает уменьшение гликогена в месте инфаркта и положительную реакцию с реактивом Шиффа.
Инфаркты могут быть множественными; часто они имеют различную давность. Отмечается наклонность к поражению тех районов, в которых уже были инфаркты раньше (см. рис. 18а и 20), например несколько лет назад.
Клинико-статистические данные показывают, что однажды перенесенные инфаркты миокарда с превращением их в рубцовую ткань не исключают длительного, даже многолетнего, периода достаточной работоспособности сердца.
Наблюдаются инфаркты по ходу атриовентрикулярной системы Гис- Тавара. Следует в то же время учитывать, что в зоне инфаркта часто отмечается своеобразное набухание мышечных волокон с просветлением их саркоплазмы. Такие группы волокон можно ошибочно принять за обычные волокна Пуркинье.
Полное заживление инфаркта рубцом наступает через 6—8 недель. До трех недель преобладает некроз и лейкоцитарная реакция. Микроинфаркты заживают спустя4—5 недель (В.Ф. Калитеевская, 1957). В созревших рубцах отмечается много эластических волокон.
Вопрос об инфарктах сердца тесно связан с вопросом о так называемой стенокардии, или грудной жабе (angina pectoris) (грудная жаба—клинический синдром, сочетающий в себе жестокие загрудинные боли, чувство страха надвигающейся смерти. Возникает в виде|приступа. Боли часто иррадиируют, особенно левую руку).
В громадном большинстве случаев грудная жаба связана с инфарктами миокарда, а инфаркты — с закупоркой или сужением соответствующих венечных артерий. Чаще речь идет о передней нисходящей ветви.
Значительные анастомозы (индивидуально подверженные колебаниям) между бассейнами правой и левой венечных артерий делают возможным постепенное закрытие сравнительно крупных и даже основных артерий без особых изменений миокарда.
Доказано существование и экстракардиальных анастомозов венечных артерий: с а. mammaria interna, с ветвями грудной аорты и ее vasa vasorum. Особенно много анастомозов около полых и легочных вен. Мышечные пласты миокарда не имеют обособленного кровоснабжения.
Рентгенография системы венечных артерий сердца в случаях смерти от инфарктов (рис. 22 и 23) показала, что, почти как правило, бассейны обеих артерий, в том числе и крупные ветви, непосредственно смыкающие эти бассейны, хорошо наливаются контрастными массами. Поскольку в норме такое смыкание за счет веточек калибром от 30 до 180 µ. (Грегг) имеет место не постоянно (около 15—20% и в зависимости от инъецируемого вещества), то приходится заключить, что анатомическая проходимость разветвлений венечных артерий при атеросклерозе основных стволов не только не хуже, но даже лучше, чем при отсутствии выраженного атеросклероза (рис. 24) и инфарктов миокарда (Блюмгарт, Б. А. Лапин).
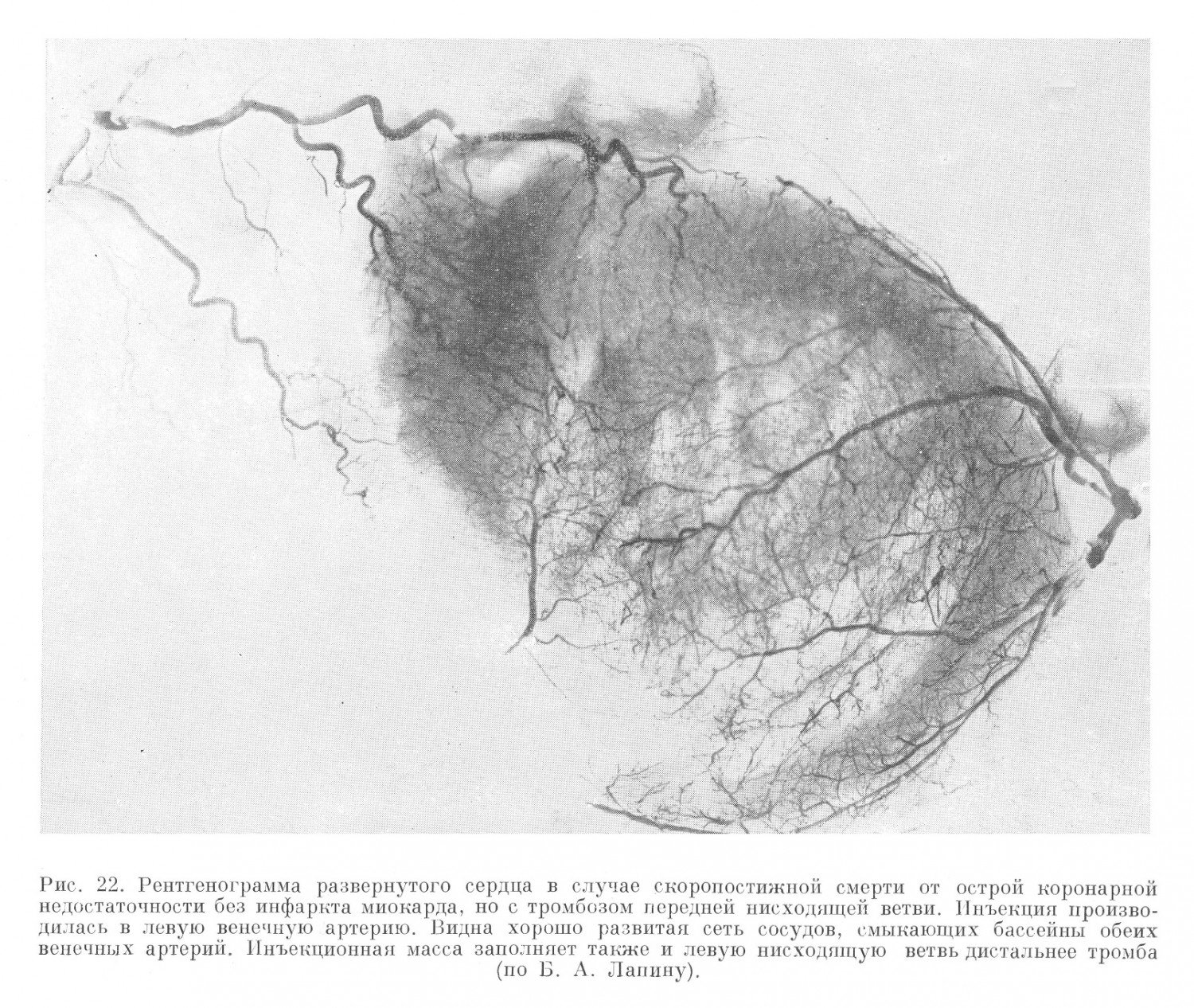
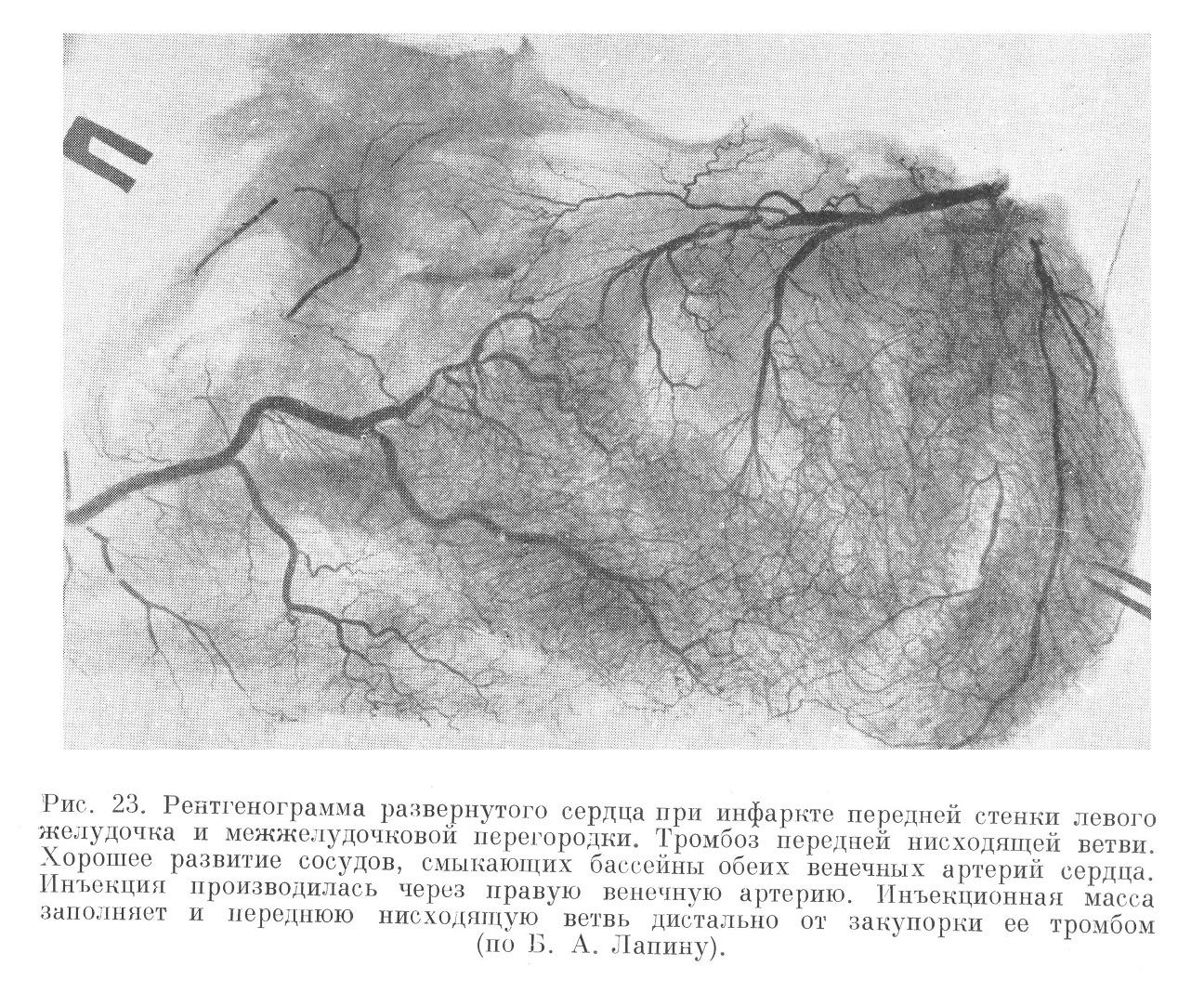
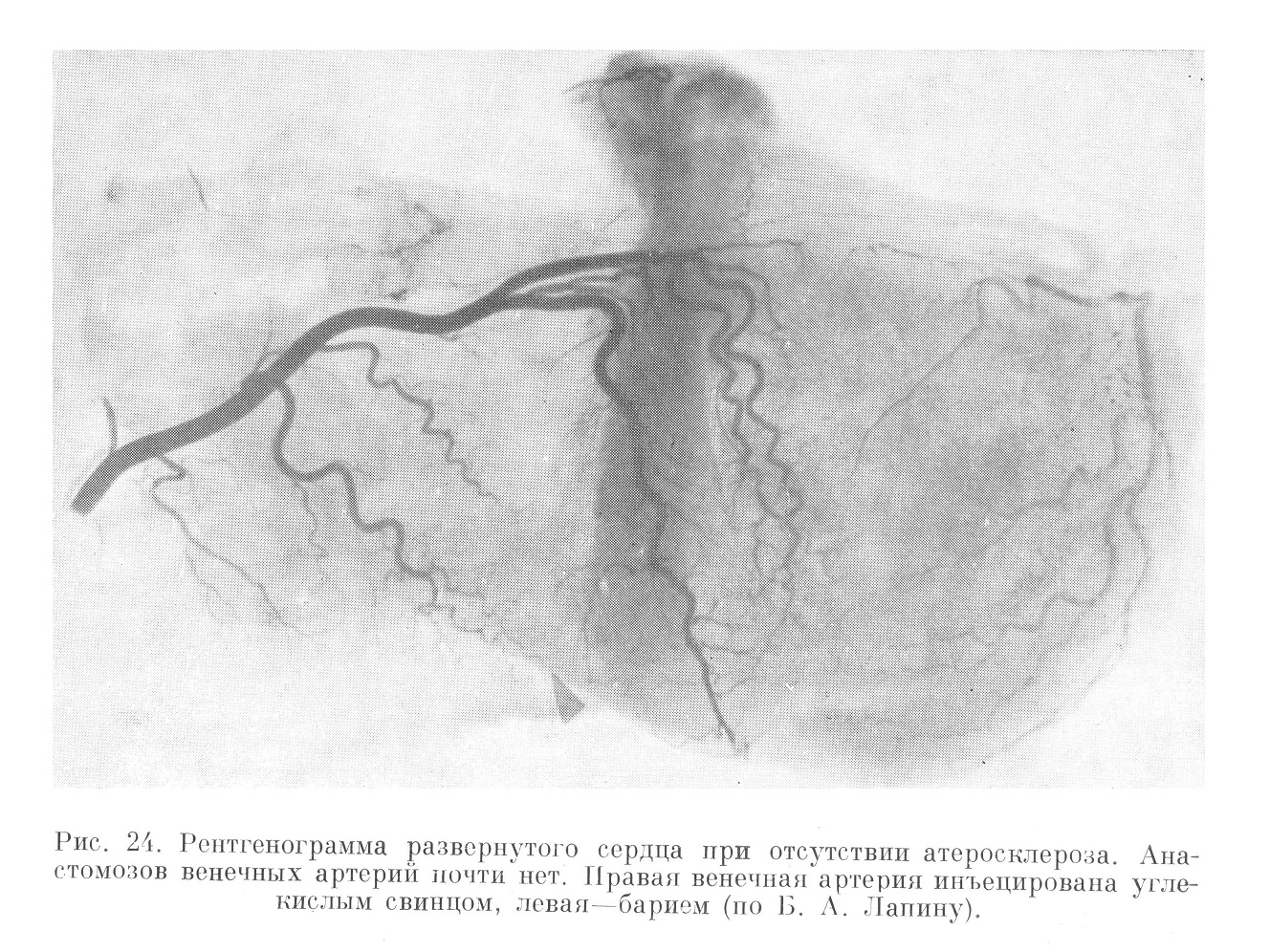
Б. А. Лапин показал также, что контрастной массой заполняются не только указанные коллатерали (за исключением сосудов, оказавшихся в зоне самого инфаркта), но и та артерия, которая была закупорена тромбом, а именно дистальная, ветвящаяся ее часть. Все это говорит о том, что сосудистая система сердца при атеросклерозе длительно приспособляется к возникающим в ней затруднениям кровообращения. Следовательно, хорошо развитая сеть артериальных анастомозов характеризует не тот или иной «тип» кровоснабжения сердца, а именно приспособление сосудистой системы к данным условиям сердечной деятельности при данных условиях венечного кровообращения.
К приспособительным следует отнести и такие явления в венечных артериях, как интрамуральное развитие капилляров и синусоидов, часто выходящих в толщу интимы. Обращает на себя внимание колоссальное развитие vasa vasorum во всех слоях склерозированных артерий; может быть доказано прямое соединение vasa vasorum с просветом артерии.
Тот факт, что в зоне самого инфаркта сосуды, не будучи тромбированы, как правило, не заполняются контрастной массой (барий и свинцовые смеси), говорит косвенно о том, что потерявшие свой тургор ткани омертвевшего миокарда вместе с его сосудами оказывают существенное препятствие для продвижения достаточно вязких жидкостей по таким сосудам. Можно предполагать, что и восстановление кровообращения в зоне возникшего инфаркта в дальнейшем происходит лишь с большим трудом; вот почему организация инфаркта идет лишь с периферии.
Склероз и закрытие веточек венечных артерий и даже самих артерий не всегда сопровождаются ангинозными явлениями, точно так же, как и последние могут быть при наличии весьма незначительных изменений в сосудах.
Отсюда вытекают следующие положения:
1) нет никакой прямой и обязательной пропорциональности между степенью коронарного склероза и частотой, интенсивностью и вообще наличием ангинозных приступов;
2) механические (анатомические) затруднения в коронарной системе — только одна из предпосылок для развития грудной жабы; другой обязательной и важнейшей предпосылкой является спазм сосуда. О том же говорят и случаи так называемой вазомоторной ангины с инфарктами у молодых людей (в возрасте до 30 лет), протекающие без особых изменений стенок коронарных сосудов, когда анатомические доказательства сердечной смерти от закрытия венечных сосудов документируются чистым тромбозом или когда эти доказательства вообще отсутствуют и возможно лишь предположительное суждение о спазме артерий на основании чисто клинических данных.
Такие случаи особенно часты при атеросклерозе, сочетающемся с гипертонической болезнью.
По данным А. В. Смольянникова и А. К. Апатенко, отсутствие закупорки венечных артерий при острой коронарной недостаточности (еще без ясно выраженного инфаркта) наблюдается почти как правило, а при наличии инфаркта миокарда частота тромбоза венечных артерий колебалась от 16,6 (при скоропостижной смерти) до 50—60% (в случаях смерти через 1—10 дней после образования инфаркта).
Это косвенно говорит о том, что тромбоз скорее завершает стенокардию (при достаточной ее продолжительности), чем начинает ее, а также и о том, что в принципе тромбоз — не первопричина инфаркта.
О значении спастического момента свидетельствуют также случаи вазомоторной ангины и паралича сердца при сильных душевных аффектах, например при испуге, в некоторых случаях травматического сотрясения сердца, в результате операций, особенно в области шеи, при эпилептических припадках и т. п.
Вопрос о связи коронарных явлений с вазомоторной ангиной еще не получил разрешения. Наиболее близкой к истине следует считать гипотезу, выдвигающую как причину ангинозных болей острую ишемию, т. е. кислородную недостаточность миокарда. В пользу этого говорит уже тот факт, что ангинозные явления могут возникать при всякой недостаточности коронарного кровообращения, чем бы она ни вызывалась: атеросклерозом, спазмом сосудов, недостаточностью аортальных клапанов любого, например сифилитического, происхождения, физической, нервно-психической нагрузкой, влияющей на нервно-мышечный и сосудистый аппарат сердца, резким понижением барометрического давления (Ю. М. Лазовский), коллапсом и т. д.
Болевой синдром при грудной жабе может быть, по-видимому, связан с изменениями в самих коронарных артериях и притом как с функциональными (спастическими), так и с морфологическими, например с внутри стеночными разрывами и кровоизлияниями. Известно, что прокол иглой всякой крупной артерии у человека может вызвать диффузную боль, побледнение покровов и т. п. (Бэнцет), к тому же вся масса чувствительных нервов сердца идет вдоль и вблизи венечных артерий, не говоря об обильной сети вазорецепторов.
В опытах Б. А. Лапина перевязка венечных артерий у обезьян, собак, кошек давала различные результаты в отношении возникновения инфаркта миокарда в зависимости от того, производилась ли такая перевязка в условиях предварительной анестезии сосудистой стенки или без нее; именно в последнем случае и возникали инфаркты.
Множественные некрозы миокарда можно получить и экспериментально, например у кролика, если его предварительно анемизировать и заставить проделать большую мышечную работу (опыты Бюхнера). Некрозы возникают при этом не беспорядочно, а преимущественно там, где имеется сравнительно слабое кровоснабжение, т. е. там, где чаще всего и скорее всего возникает несоответствие между функциональным напряжением и кровоснабжением.
Функциональное несоответствие между работой миокарда и кровоснабжением можно создать путем раздражения блуждающего нерва (А. И. Смирнов).
Принципиально то же самое наблюдается и при дистрофии миокарда сильно отягощенного гипертрофированного сердца, например в финале декомпенсации при пороках клапанов; эта дистрофия не только носит гнездный характер, но и по месту своего развития соответствует тем районам, которые излюбленно поражаются при грудной жабе. Другими словами, локализация как гнездной жировой дистрофии, так и участков миомаляции подчеркивает известную ранимость отдельных районов миокарда, связанную с разными условиями кровоснабжения, безотносительно к состоянию сосудистых стенок.
Была показана возможность развития некрозов миокарда при усиленном «подстегивании» миокарда строфантином, адреналином. Оказалось, что резкое физическое напряжение сердца в указанном выше эксперименте Бюхнера с кроликом может вызвать рассеянные некрозы миокарда и без предварительной анемии.
Общее малокровие как таковое, т. е. вне нервного фактора, вообще не играет существенной роли в развитии грудной жабы и инфаркта миокарда. Это доказывается, в частности, и тем, что при злокачественном малокровии ангинозные явления возникают лишь в 2—3% случаев и то лишь у пожилых лиц, что не исключает возможности совпадения двух заболеваний.
Итак, механизм развития и сущность грудной жабы нельзя свести только к большей или меньшей степени органического или спастического
сужения венечных артерий или к закрытию их, в частности тромбом. Исходным пунктом в этом механизме может явиться гипо- или аноксия, обусловленная функциональным несоответствием между потребностью миокарда в кислороде и его доставкой. Атеросклероз венечных артерий, приводя к некоторой ригидности артерий, снижает их приспособляемость к усилившейся почему-либо работе миокарда; в частности, он делает почти невозможным расширение артериального русла, диктуемое такой работой, а холестериновая инфильтрация стенки артерий усиливает спастические явления.
Очень важное место во всем вопросе об инфаркте миокарда и грудной жабе занимает тромбоз венечных артерий.
Такой тромбоз встречается в значительном большинстве (70—80%) случаев инфарктов миокарда, возникающих на фоне атеросклероза. Однако у скоропостижно умерших тромбоз венечных артерий отсутствует в подавляющем большинстве случаев (Н. Г. Шуляковская, Б. А. Лапин, С. Г. Моисеев, А. В. Смольянников и А. К. Апатенко). Из этого надлежит сделать вывод, что развитие грудной жабы и инфаркта миокарда отнюдь не обязательно связано с тромбозом артерий и что этот тромбоз часто представляет лишь сопутствующее или последовательное явление.
Есть все основания думать, что легкие случаи грудной жабы и случаи средней тяжести тромбозом артерий вообще не сопровождаются.
Итак, инфарктообразование отнюдь не обязательно связано с тромбозом. Об этом говорят и следующие наблюдения:
1) инфаркт может находиться в бассейне нетромбированного сосуда;
2) инфаркт по своей площади иногда явно превосходит бассейн тромбированного сосуда;
3) хорошее развитие коллатералей между бассейнами правой и левой венечной артерии затрудняет понимание инфаркта как простого следствия механической закупорки одной из артерий или ее веточки.
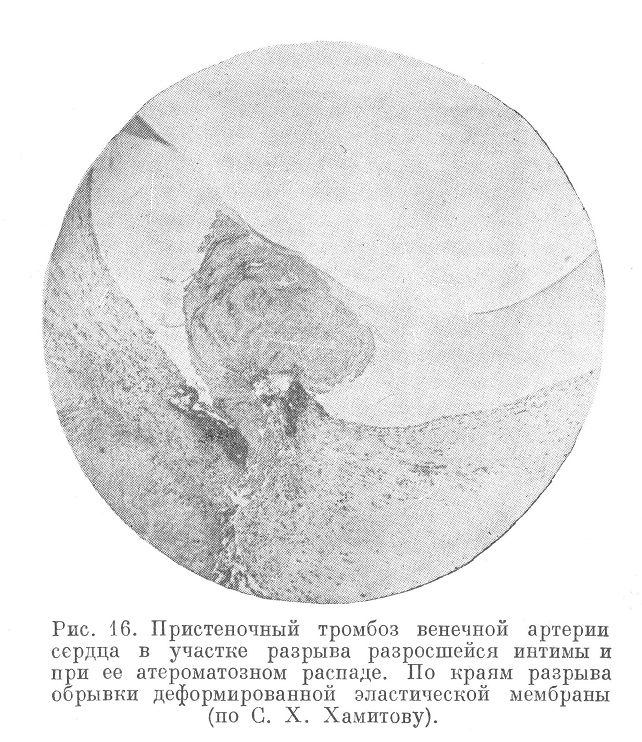
В то же время следует иметь в виду, что взаимоотношение вазомоторного фактора как ведущего с фактором атеросклероза и тромбоза может быть довольно тесным. Дело в том, что при спастическом сокращении специфически измененных артерий в них дополнительно возникают острые структурные нарушения в виде некрозов и прямых разрывов интимы (см. рис. 16), нередко с выкрашиванием содержимого «атером», в частности кристаллов холестерина, в просвет сосуда (С. X. Хамитов).
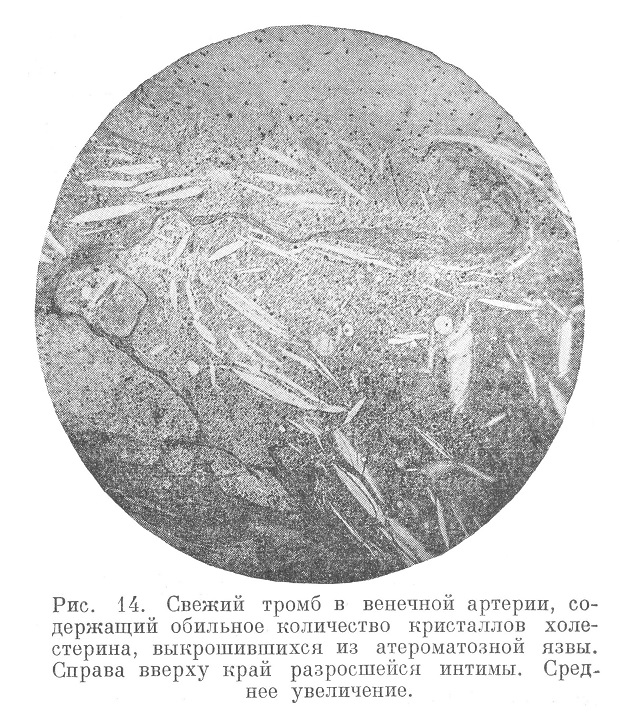
Такое сочетание функциональных расстройств кровотока с деструктивными изменениями интимы и с биохимическими изменениями протекающей крови делает коагуляцию последней (т. е. тромбоз) неизбежным явлением. Характер тромба (красный тромб), наличие в нем кристаллов холестерина (см. рис. 14) говорят о быстроте коагуляции. Такой же характер часто имеет тромб и при затянувшейся грудной жабе (status anginosus). Это опять указывает на вторичность развития тромба, не позволяя видеть в нем причину всего явления.
Очевидно, что в зависимости от интенсивности и продолжительности спазма, от степени деструкции атероматозной бляшки частота тромбоза будет варьировать. Спастические сокращения могут вызвать лишь внутренние разрывы интимы с интрамуральными кровоизлияниями; они могут быть причиной отека, т. е. плазматического пропитывания тканей бляшки. И в том и в другом случае приступ стенокардии может не сопровождаться ни инфарктом миокарда, ни тромбозом сосуда. Сюда и относятся такие случаи, когда атеросклеротические изменения венечных артерий с интрамуральными отложениями гемосидерина, с рубцами в миокарде являются единственным морфологическим доказательством наличия в прошлом стенокардических приступов. Логически необходимо допустить, что такие приступы не обязательно должны протекать в сопровождении инфарктов в макро- или микроскопическом их выражении.
Экспериментальные исследования говорят о значительных трудностях в дозировании сужения венечных артерий для получения инфаркта или типичных изменений электрокардиограммы. Так, сужение до 70% просвета артерии может еще не вызывать таких изменений. По-видимому, сужение само по себе даже лишено особого значения, если оно чисто механическое и не возникает приступообразно с иррадиацией спазма на ту или иную группу сосудистых ветвей, иначе говоря, при одновременном выпадении адекватных приспособительных механизмов в кровоснабжении миокарда.
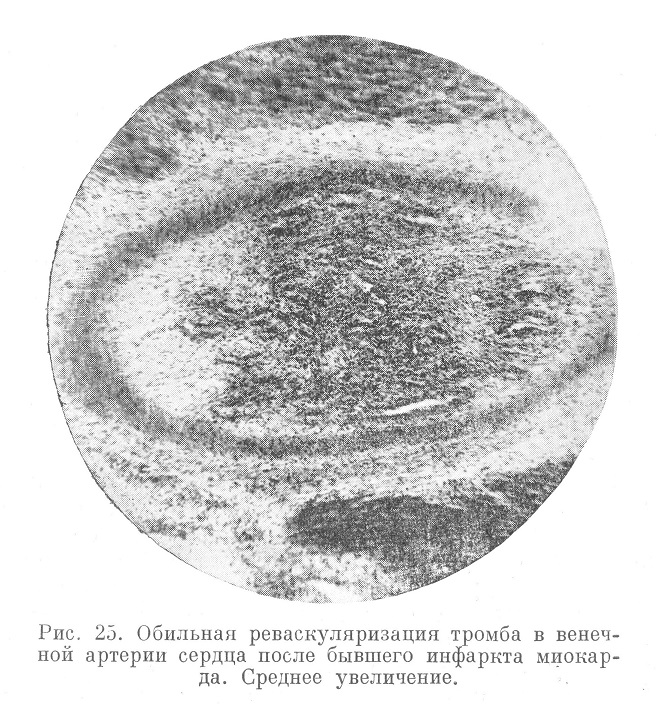
Возникшие в венечных артериях тромбы в дальнейшем подвергаются организации и обильной васкуляризации (рис. 25).
Дополнительные системы кровоснабжения сердца при атеросклерозе его артерий, как-то система тебезиевых сосудов (являющаяся, по Н. И. Лепорскому, «заместительным аппаратом кровообращения» в миокарде), артерио-венозные анастомозы еще мало изучены. Имеются наблюдения (А. В. Архангельский, П. О. Ульянецкая), что артериовенозные анастомозы при инфарктах миокарда испытывают значительные изменения в виде гипертрофии и гиперплазии сократительных элементов, вслед за чем развивается склероз функционального слоя замыкающих артерий, что приводит, по-видимому, к переключению кровотока в венозную систему, минуя капилляры миокарда.
В целях усиления питания миокарда при атеросклерозе венечных артерий предложена операция артериализации вен сердца, образующих венозный синус.
Что касается изменений интрамурального нервного аппарата сердца (Ю. М. Лазовский, 1944; В. В. Нестайко, 1954; А. Ф. Киселева, 1954), то они сводятся к разнообразным повреждениям нервных клеток, синапсов, волокон, рецепторов. Н. К. Пермяков обнаружил значительные изменения в пучковом узле блуждающего нерва и в шейных узлах симпатического ствола.
А. И. Серанова (1956), изучая нервные элементы венечных артерий сердца при атеросклерозе и гипертонической болезни, пришла к заключению, что изменения этих элементов «непостоянны и не резко выражены» и, по-видимому, не имеют существенного патогенетического значения, являясь вторичными.
 Занятие 1-е. Вакцины и анатоксины. Вопросы для обсуждения. 1. Искусственный иммунитет, активный и пассивный. 2. Препараты для создания искусственного активного иммунитета: вакцины и анатоксины. 3. Виды вакцин: живые, убитые и химические. 4. Способы приготовления вакцин. 5. Анатоксины нативные и очищенные, их получение и титрован... Читать далее... |
|