Размеры молекул сообщают растворам белка особые свойства, характерные для коллоидов. Что представляют собой и чем отличаются от обычных растворов коллоидные растворы? В свое время, в середине прошлого века, имелась тенденция разделять все вещества на два мира: коллоиды и кристаллоиды.
Последние, например, NaCl, при удалении растворителя выпадают в виде кристаллов; они проходят через животные перегородки и обладают рядом других свойств. Коллоиды не диффундируют через мембраны, после испарения образуют студни и т. д. Однако более детальный анализ показал, что любое вещество можно получить в коллоидальном состоянии,— все зависит лишь от степени его раздробления. Системы с частицами до 0,2 u образуют суспензии. Такие частицы, например, жировые капельки молока, различимы в обычный микроскоп. При дальнейшем уменьшении диаметра частиц мы вступаем в область коллоидных размеров (от 0,1 u до 1 mu). Наконец, при раздроблении ниже 1 mu лежит область истинных растворов. Следовательно, свойства раствора того или иного вещества зависят от размеров частиц. Оказалось, что такой обычный кристаллоид, как поваренная соль, при раздроблении ее в бензоле или толуоле дает типичный коллоидный раствор.
Каждый коллоидный раствор является неоднородным, гетерогенным. В нем различают растворитель или непрерывную среду, интермицеллярную жидкость, дисперсионную среду, в которой взвешены коллоидные частицы — мицеллы, гранулы или дисперсная фаза. О гетерогенности коллоидных растворов можно судить на основании ряда данных. Так, если пропустить через коллоидный раствор яркий пучок света, то в зоне прохождения луча будет наблюдаться свечение раствора. Оно обусловлено тем, что коллоидные частицы под влиянием сильного освещения сами становятся источником рассеянного света, который и улавливается нашим глазом.
На этом принципе основана ультрамикроскопия, или исследование объектов в темном поле. При боковом освещении коллоидной системы в темном поле зрения микроскопа видно бесчисленное множество светящихся точек, находящихся в непрерывном молекулярном движении. Это не что иное, как окруженные дифракционными кольцами мицеллы, диспергированные в растворителе.
Дисперсионную среду можно отделить от мицелл путем фильтрования, но в этом случае надо пользоваться не обычными бумажными фильтрами, пропускающими коллоидные частицы, а специальными фильтрами (желатиновыми, коллодийными) с очень мелкими порами. Такое разделение называется ультрафильтрацией. В настоящее время форму и размеры субмикронов можно непосредственно наблюдать и фотографировать при помощи электронного микроскопа.
Почему, спрашивается, коллоидные частицы не оседают, почему коллоидный раствор является устойчивым, стабильным?
Связать это только с малыми размерами их нельзя, ибо частицы обладают способностью соединяться в более крупные агрегаты, склеиваться или агглютинировать. Устойчивость коллоидных растворов обусловлена тем, что частицы несут на себе электрические заряды одинакового знака. Известно, что одноименно заряженные тела взаимно отталкиваются, вследствие чего исключается возможность агглютинирования частиц. Если же лишить последние заряда, добавив, например, к раствору электролит, то тотчас же произойдет выпадение растворенного вещества в осадок. Произойдет коагуляция или разделение фаз коллоидного раствора, которое является необратимым.
Однако не все коллоиды коагулируют при нейтрализации заряда мицелл. Существует большая группа коллоидов, таких, как желатина, гумми-арабик и т. д., у которых имеется два фактора устойчивости, как бы двойная страховка против коагуляции. Одним из них является электрический заряд, вторым — наличие так называемой водной или сольватной оболочки. Дело в том, что частицы этих коллоидов обладают способностью притягивать к себе молекулы растворителя, ориентируя их определенным образом. Молекулы дисперсионной среды в непосредственной близости от мицелл располагаются плотно друг около друга, образуя своего рода атмосферу, постепенно разрыхляющуюся по мере удаления от поверхности частицы и называемую сольватной оболочкой.
 Последняя складывается из двух слоев: внутреннего плотного, где силы притяжения проявляются наиболее отчетливо, и наружного диффузного, постепенно переходящего в неориентированную интермицеллярную жидкость (рис. 1). Последняя складывается из двух слоев: внутреннего плотного, где силы притяжения проявляются наиболее отчетливо, и наружного диффузного, постепенно переходящего в неориентированную интермицеллярную жидкость (рис. 1).
Те коллоиды, устойчивость которых зависит не только от заряда частиц, но и от присутствия водной оболочки, называются гидрофильными в отличие от гидрофобных коллоидов, стабильность которых обусловлена только зарядом мицелл. Понятно, что гидрофильные коллоиды устойчивее гидрофобных. Для того чтобы вызвать их коагуляцию, необходимо не только нейтрализовать заряд, но и разрушить водную оболочку, которая препятствует - объединению частиц. Гидрофильные коллоиды отличаются от гидрофобных многими свойствами: они обладают высокой вязкостью, частицы их не обнаружимы ультрамикроскопически и т. д. Однако все эти различия обусловлены присутствием водных оболочек. После их удаления гидрофильные коллоиды приобретают свойства гидрофобных.
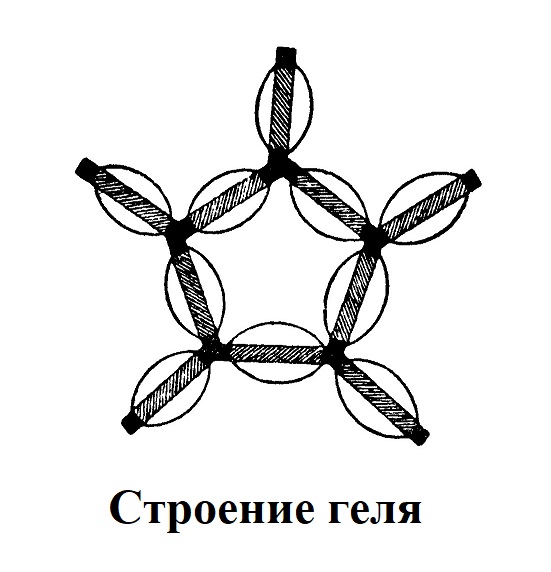 Гидрофильные коллоиды могут находиться в двух различных состояниях: в виде раствора — золя или студня — геля. Переход из золя в гель и обратно из геля в золь обратим. Примером этого может служить раствор желатины, который при охлаждении остудневает (гель), а при нагревании вновь переходит в жидкое состояние (золь). Возможность такого рода переходов объясняют тем, что палочковидные мицеллы гидрофильных коллоидов окружены водными оболочками не на всем протяжении: концы их гидрофобны. При желатинизации, т. е. при переходе золя в гель, заряд этих участков снижается или исчезает. Благодаря этому частицы начинают соединяться между собой концами и образуют непрерывную трехмерную сеть, все промежутки которой заполнены дисперсионной средой (рис. 2). Гидрофильные коллоиды могут находиться в двух различных состояниях: в виде раствора — золя или студня — геля. Переход из золя в гель и обратно из геля в золь обратим. Примером этого может служить раствор желатины, который при охлаждении остудневает (гель), а при нагревании вновь переходит в жидкое состояние (золь). Возможность такого рода переходов объясняют тем, что палочковидные мицеллы гидрофильных коллоидов окружены водными оболочками не на всем протяжении: концы их гидрофобны. При желатинизации, т. е. при переходе золя в гель, заряд этих участков снижается или исчезает. Благодаря этому частицы начинают соединяться между собой концами и образуют непрерывную трехмерную сеть, все промежутки которой заполнены дисперсионной средой (рис. 2).
При переходе геля в золь концы мицелл приобретают заряд, отталкиваются друг от друга, и частицы переходят в свободное состояние.
У некоторых гидрофильных коллоидов наблюдается явление тиксотропии, т. е. переход из геля в золь при механическом воздействии: помешивании, встряхивании и т. д.
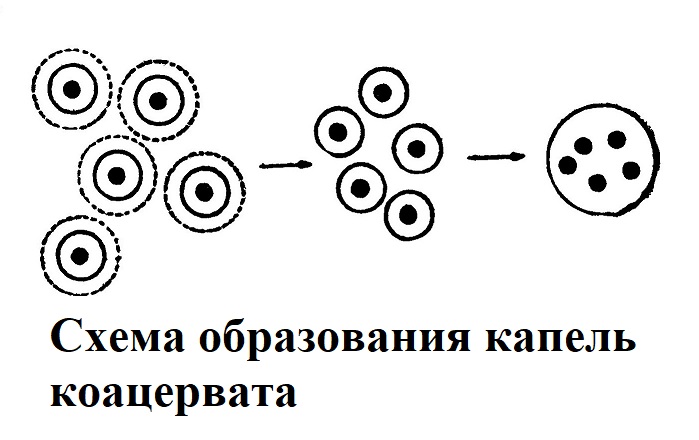
Наконец, надо упомянуть еще об одном свойстве гидрофильных коллоидов, а именно о способности их к коацервации (скучиванию). Коацервация наблюдается при смешивании растворов различных гидрофильных коллоидов, например, желатины и гумми-арабика при известной кислотности среды. В этих условиях начинается коагуляция, но она протекает очень своеобразно и не доходит до конца (рис. 2). Частицы утрачивают диффузный слой водной оболочки, а затем объединяют свои плотные слои. Вследствие этого из раствора начинают выделяться сначала очень мелкие, затем увеличивающиеся путем слияния капельки коацервата. Коллоидный раствор расслаивается на две части — коацерват, содержащий концентрированный коллоид, и окружающую среду, бедную мицеллами. Явление коацервации широко распространено в клетке (рис. 3).
Благодаря наличию большого количества мельчайших частиц, в коллоидных системах развиваются громадные суммарные поверхности. Вот почему поверхностные явления играют столь большую роль в коллоидных системах. На частицах может происходить связывание, адсорбция самых различных веществ, в первую очередь поверхностно активных, т. е. понижающих поверхностное, или, точнее, пограничное, натяжение. На поверхности мицелл может осуществляться связывание ферментов и других жизненно важных соединений; адсорбируются также и различные питательные материалы. Все это создает условия, благоприятствующие протеканию различных химических реакций.
К гидрофильным коллоидам принадлежат и белки, составляющие основу протоплазмы. Такими же свойствами обладает и ряд других соединений, входящих в ее состав. Вот почему мы говорим о коллоидной природе протоплазмы, вот почему изучение свойств коллоидов имеет существенное биологическое значение.
У белков, кроме уже рассмотренных качеств, свойственных большинству гидрофильных коллоидов, наблюдается явление денатурации. Сущность ее до сих пор окончательно не выяснена. Несомненно, что при денатурации гидрофильные белки приобретают гидрофобность, теряют устойчивость и легко коагулируют. Типичная денатурация происходит при нагревании белков. Например, куриный белок при этом утрачивает прозрачность, свертывается. Однако не надо думать, что коагуляция и есть денатурация, — она ее следствие. Можно денатурировать белок, например, мочевиной, и он не теряет своей прозрачности; вместе с тем многие свойства его меняются и при соответствующих условиях такой раствор коагулирует. Денатурированный белок обладает способностью жадно поглощать, адсорбировать красители. Пользуясь этим показателем, легко можно судить о начавшейся денатурации даже тогда, когда белок внешне кажется неизмененным.
 Занятие 1-е. Вакцины и анатоксины. Вопросы для обсуждения. 1. Искусственный иммунитет, активный и пассивный. 2. Препараты для создания искусственного активного иммунитета: вакцины и анатоксины. 3. Виды вакцин: живые, убитые и химические. 4. Способы приготовления вакцин. 5. Анатоксины нативные и очищенные, их получение и титрован... Читать далее... |
|
 Последняя складывается из двух слоев: внутреннего плотного, где силы притяжения проявляются наиболее отчетливо, и наружного диффузного, постепенно переходящего в неориентированную интермицеллярную жидкость (рис. 1).
Последняя складывается из двух слоев: внутреннего плотного, где силы притяжения проявляются наиболее отчетливо, и наружного диффузного, постепенно переходящего в неориентированную интермицеллярную жидкость (рис. 1). Гидрофильные коллоиды могут находиться в двух различных состояниях: в виде раствора — золя или студня — геля. Переход из золя в гель и обратно из геля в золь обратим. Примером этого может служить раствор желатины, который при охлаждении остудневает (гель), а при нагревании вновь переходит в жидкое состояние (золь). Возможность такого рода переходов объясняют тем, что палочковидные мицеллы гидрофильных коллоидов окружены водными оболочками не на всем протяжении: концы их гидрофобны. При желатинизации, т. е. при переходе золя в гель, заряд этих участков снижается или исчезает. Благодаря этому частицы начинают соединяться между собой концами и образуют непрерывную трехмерную сеть, все промежутки которой заполнены дисперсионной средой (рис. 2).
Гидрофильные коллоиды могут находиться в двух различных состояниях: в виде раствора — золя или студня — геля. Переход из золя в гель и обратно из геля в золь обратим. Примером этого может служить раствор желатины, который при охлаждении остудневает (гель), а при нагревании вновь переходит в жидкое состояние (золь). Возможность такого рода переходов объясняют тем, что палочковидные мицеллы гидрофильных коллоидов окружены водными оболочками не на всем протяжении: концы их гидрофобны. При желатинизации, т. е. при переходе золя в гель, заряд этих участков снижается или исчезает. Благодаря этому частицы начинают соединяться между собой концами и образуют непрерывную трехмерную сеть, все промежутки которой заполнены дисперсионной средой (рис. 2).