Возбудитель дифтерии — факультативный аэроб. Температурный оптимум 37°С, рН 7,6—7,8. На простых питательных средах растет плохо. Для выращивания используют элективные сывороточные среды (Ру и Леффлера) и среды с теллуритом калия: кровяно-тёллуритовые (среда Клауберга), сывороточно-теллуритовые (среда/Гинсдаля), хинозольная среда Бучина. Коринебактерии дифтерии при росте на теллуритовых средах восстанавливают металлический теллур из теллурита калия, поэтому колонии их темного цвета. На чашке со средой Бучина колонии дифтерийных бактерий окрашены в синий цвет. Колонии на средах Ру и Леффлера выпуклые, блестящие, их рост напоминает шагреневую кожу. На бульоне Мартена характерен рост в виде пленки.
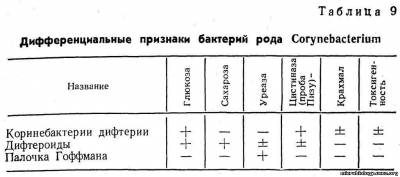
По культуральным, ферментативным и другим свойствам различают три типа коринебактерий дифтерии: gravis, mitis, intermedius. На теллуритовых средах бактерии типа gravis образуют колонии плоские, крупные, с радиальной исчерченностью и зубчатыми краями, серовато-черного цвета. Колонии коринебактерий дифтерии типа mitis более мелкие, выпуклые, блестящие, гладкие, черного цвета. Тип intermedius занимает промежуточное положение. Биохимические свойства дифтерийных бактерий позволяют дифференцировать их от непатогенных представителей рода Corynebacterium, а также разделить на типы (табл. 9).
Коринебактерии дифтерии ферментируют глюкозу, мальтозу, галактозу до кислоты, не изменяют лактозу, сахарозу, маннит, не разлагают мочевину (проба на уреазу), продуцируют фермент цистиназу (проба Пизу). Бактерии типа gravis ферментируют крахмал, а типа mitis не ферментируют.
Токсинообразование. Дифтерийные бактерии образуют сильный экзотоксин, который при введении в организм избирательно поражает сердечную мышцу, надпочечники и периферическую нервную систему. Дифтерийный токсин — простой белок, состоящий из двух фракций: фракция А связана с токсической функцией, фракция В — с функцией прикрепления токсина к чувствительным клеткам организма. Силу токсина определяют на морских свинках и измеряют минимальной смертельной дозой (Dim), убивающей животное массой 250 г в течение 4 дней. Дифтерийный токсин малоустойчив, легко разрушается при 60°С под действием солнечного света и различных химических веществ. Под влиянием 0,3—0,4% формалина и выдерживания при 40°С в течение месяца превращается в не ядовитое соединение — анатоксин. Анатоксин сохраняет иммуногенные свойства и его используют для иммунизации людей.
Ранее считали, что токсигенным является тип gravis, а тип mitis нетоксигенен. Однако в последние годы установлено, что бактерии типов как gravis, так и mitis могуг быть и токсигенными, и нетоксигенными.
Устойчивость. Дифтерийные бактерии довольно устойчивы к низкой температуре. В высушенной дифтерийной пленке остаются жизнеспособными 3—4 мес, на различных предметах и одежде сохраняются много дней. Чувствительны к действию высоких температур: при кипячении погибают мгновенно, при 60°С — в течение 10 мин. Быстро гибнут при действии прямого солнечного света, дезинфицирующих растворов: 3—5% раствор карболовой кислоты убивает их в течение минуты.
Антигенная структура у дифтерийных бактерий изучена недостаточно. Описано 11 серологических типов, отличающихся между собой в реакции агглютинации со специфическими типовыми дифтерийными сыворотками.
У возбудителей дифтерии изучены типовые фаги, с помощью которых производят фаготипирование выделенных штаммов, что имеет большое значение в эпидемиологической практике для выявления источника инфекции.
Патогенность. Животные дифтерией не болеют. В экспериментальных условиях наиболее чувствительны к заражению морские свинки и кролики. При подкожном введении морским свинкам культуры или токсина развивается картина токсикоинфекции, на месте инъекции возникают воспаление и некроз, а затем животное гибнет.
Патогенез и клиника. Входными воротами дифтерийных микробов являются слизистые оболочки носоглотки, иногда глаз, половых органов (у девочек), кожа и раны. Инкубационный период равен 3—10 дням. Микроб локализуется на месте входных ворот, где возникает местное фибринозное воспаление и образуются дифтеритические пленки серовато-желтого цвета, тесно спаянные с подслизистым слоем. Иногда процесс со слизистой оболочки глотки распространяется на гортань и бронхи, что сопровождается отеком, сужением гортани и может привести к асфиксии.
В месте своего внедрения возбудители дифтерии размножаются, выделяют экзотоксин, который всасывается в кровь и обусловливает тяжелую общую интоксикацию организма, избирательно поражая сердечную мышцу, надпочечники, нервные клетки.
Иммунитет. После перенесенной инфекции стойкий, хотя возможны повторные заболевания. Формирование иммунитета связано с накоплением в крови антитоксина. Антитоксин к дифтерийному токсину обнаруживают у детей до 6-месячного возраста в результате передачи его с кровью матери через плаценту. У взрослых, он также накапливается вследствие постоянной «бытовой» иммунизации. О состоянии иммунитета к дифтерии можно судить по реакции Шика. Для этого во внутреннюю поверхность предплечья внутрикожно вводят 1/40 Dlm дифтерийного токсина. Токсин перед введением разводят таким образом, чтобы данная доза содержалась в объеме 0,2 мл. Для контроля в другую руку вводят прокипяченный токсин. При отсутствии иммунитета на месте введения токсина через 2—3 дня появляются краснота и припухлость диаметром до 2 см. Если же ребенок невосприимчив к дифтерии, реакция будет отрицательной вследствие нейтрализации введенного токсина содержащимся в крови антитоксином.
В настоящее время применение реакции Шика ограничено и ее используют только по эпидемиологическим показаниям.
Микробиологическая диагностика. Лабораторное исследование проводят с целью ранней диагностики заболевания и выявления бактерионосителей среди здоровых лиц. Материалом для исследования служат дифтеритическая пленка или отделяемое из мест поражения, а также слизь из носа и глотки. Материал берут стерильным ватным тампоном и немедленно отправляют в лабораторию. Если материал не может быть засеян в течение ближайших 3—4 ч, то во избежание снижения высеваемости его берут тампоном, смоченным 5% раствором глицерина в изотоническом растворе хлорида натрия. С этой же целью материал забирают тампоном, смоченным 2% раствором теллурита калия.
Основным методом диагностики является микробиологический.
Первый день. Посев производят на чашки со средой Клауберга или Тинсдаля, а также на среду Бучина. При необходимости, по требованию врача, берут материал еще одним тампоном для микроскопического исследования. С тампона делают мазок, окрашивают его по Граму и по Нейссеру.
Второй день. Через 18—24 ч инкубации в термостате просматривают посевы. На средах с теллуритом калия колонии дифтерийных бактерий окрашены в черный цвет разной степени интенсивности. Колонии дифтероидов влажные, выпуклые, коричневого или серого цвета.
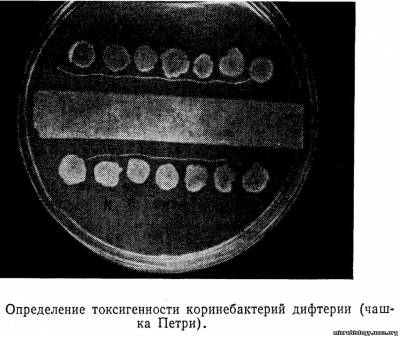
На среде Бучина колонии возбудителей дифтерии синего цвета, дифтероидов — бесцветные, а палочек Гоффмана — голубоватые. Для выделения чистой культуры часть отдельно лежащей подозрительной колонии пересевают на скошенный сывороточный агар, или свернутую сыворотку (среда Ру или Леффлера). Вторую половину колонии пересевают в виде бляшки на поверхность среды, для определения токсигенности и, не прожигая петли, производят посев уколом в пробирку со столбиком питательной среды с цистином (проба Пизу) для выявления фермента цистиназы.
Токсигенность выделенной культуры в настоящее время определяют методом диффузионной преципитации в геле.
Третий день. Со скошенного сывороточного агара или свернутой сыворотки приготовляют мазок, окрашивают, по Нейссеру, микроскопируют. Учитывают токсигенность. - Отмечают появление коричневого облачка вокруг темного стержня по ходу укола в среде Пизу, что характерно для роста дифтерийных микробов. Для изучения ферментативных свойств и установления типа возбудителя дифтерии производят посев в среды Гисса с глюкозой, сахарозой, крахмалом и в среду с мочевиной для определения наличия уреазы.
Четвертый день. Окончательный положительный ответ дают при наличии типичных дифтерийных бактерий в мазках из чистой культуры, характерных колоний на Средах с теллуритом калия, результата пробы на токсигенность и определения ферментативных свойств. Принадлежность выделенной культуры к виду Corynebacterium diphtheriae можно установить в реакции агглютинации с поливалентной дифтерийной сывороткой. Однако многие нетоксигенные штаммы возбудителей дифтерии не агглютинируются этой сывороткой. С помощью типовых агглютинирующих дифтерийных сывороток можно установить серологический тип возбудителя.
Для ускоренной диагностики дифтерии стерильный ватный тампон смачивают нативной сывороткой, которую свертывают на тампоне нагреванием при 80°С. Сывороточным тампоном берут мазок из патологического очага и инкубируют в термостате в течение 3—4 ч. Затем делают мазки, окрашивают их по Нейссеру. У больных дифтерией обнаруживается значительное число возбудителя в мазках.
Профилактика и лечение. Для предупреждения распространения дифтерии необходимы ранняя диагностика заболевания, госпитализация больных, дезинфекция, выявление носителей дифтерийных микробов среди детей и лиц, работающих в детских учреждениях. Специфическую профилактику осуществляют введением дифтерийного анатоксина для создания активного иммунитета против дифтерии. В настоящее время в Советском Союзе проводят обязательную вакцинацию детей комплексной вакциной АКДС, в состав которой входят, помимо дифтерийного, столбнячный анатоксин и взвесь убитых коклюшных бактерий. Для ревакцинации используют вакцину АДС-М (без коклюшных бактерий) с уменьшенным содержанием анатоксинов. В особых случаях детям, контактировавшим с больным дифтерией, для создания кратковременного пассивного иммунитета вводят наряду с анатоксином противодифтерийную антитоксическую сыворотку.
Для лечения применяют противодифтерийную антитоксическую сыворотку в дозе 1000—5000 АЕ на 1 кг массы тела ребенка. Раннее введение сыворотки имеет часто решающее значение в исходе болезни. Одновременно назначают антибиотики тетрациклинового ряда, пенициллин, сульфаниламидные препараты. Применяют также сердечные средства, витамины, переливание крови и др.